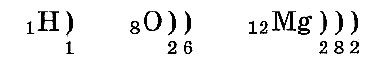Как устроена электронная оболочка атома что такое электронный слой атома
Строение электронной оболочки атома
Атом состоит из ядра и электронной оболочки.
Электронная оболочка атома – это совокупность всех электронов в данном атоме.
Химические свойства элементов определяются строением электронных оболочек их атомов.
В 20-х годах ХХ в. ученые установили, что электрон имеет двойственную природу: он является одновременно частицей и волной (имеет свойства частицы и свойства волны).
Представление о двойственной природе электрона привело к созданию квантово-механической теории строения атома.
Согласно этой теории, электрон (как и другие микрочастицы) не имеет определенной траектории движения. Можно говорить только о вероятности нахождения электрона в разных частях атомного пространства.
Часть атомного пространства, в которой вероятность нахождения данного электрона наибольшая (равна 90%), называется атомной орбиталью.
Каждый электрон в атоме занимает определенную орбиталь и образует электронное облако, которое является совокупностью различных положений быстро движущегося электрона.
Атомная орбиталь и облако электрона, который занимает эту орбиталь, имеют одинаковый размер, одинаковую форму и одинаковое направление в пространстве.
Для характеристики орбиталей и электронов используются квантовые числа.
Энергия и размер орбитали и электронного облака характеризуются главным квантовым числом n.
Главное квантовое число принимает значения целых чисел от 1 до ∞(бесконечности): n = 1, 2, 3, 4, 5, 6, 7…∞
Орбитали, которые имеют одинаковое значение n, близки между собой по энергии и по размеру.
Совокупность орбиталей, которые имеют одинаковое значение главного квантового числа, — это энергетический уровень.
Энергетические уровни обозначаются большими буквами латинского алфавита.
Совокупность электронов, которые находятся на одном энергетическом уровне, — это электронный слой.
На одном энергетическом уровне могут находиться орбитали (электронные облака), которые имеют различные геометрические формы.
Форма орбиталей и облаков характеризуется побочным (орбитальным) квантовым числом l.
Для орбиталей данного энергетического уровня побочное (орбитальное) квантовое число принимает значения целых чисел от 0 до n-1.
Орбитали, для которых l = 0, имеют форму шара (сферы) и называются s-opбиталями (условно изображаются в виде окружности):
s –орбитали имеются на всех энергетических уровнях.
На K-уровне (на первом энергетическом уровне) имеется только s-орбиталь.
Орбитали, для которых l=1, имеют форму гантели и называются р-орбиталями:
р-Орбитали имеются на всех энергетических уровнях, кроме первого (K) уровня.
Орбитали с большими значениями l имеют более сложную форму и обозначаются так:
l = 2: d-орбитали;
l = 3: f-орбитали.
d-Орбитали есть на всех энергетических уровнях, кроме первого (K) и второго (L) уровней.
f-Oрбитали есть на всех энергетических уровнях, кроме первого (K), второго (L) и третьего (М) уровней.
Энергия орбиталей (Е), которые находятся на одном энергетическом уровне, но имеют различную форму, неодинакова:
Итак, каждая орбиталь и электрон, который находится на этой орбитали, характеризуются тремя квантовыми числами: главным n, побочным l и магнитным m1.
Электрон характеризуется еще одним — спиновым квантовым числом (от англ. to spin — кружить, вращать).
Спиновое квантовое число (спин электрона) ms, характеризует вращение электрона вокруг своей оси и принимает только два значения: +1/2 и – 1/2.
Схематично это можно показать так:
Электрон со спином +1/2 — условно изображают так: ↑; со спином —1/2: ↓
Принцип Паули гласит:
В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
Поэтому на одной орбитали не может быть больше двух электронов; эти два электрона имеют одинаковый набор трех квантовых чисел (n, l, m1) и должны отличаться спинами (спиновым квантовым числом ms:
Два электрона, которые находятся на одной орбитали, называются спаренными (или неподеленной электронной парой). Спаренные электроны являются электронами с противоположными (антипараллельными) спинами.
Как устроена электронная оболочка атома что такое электронный слой атома
Ключевые слова конспекта: строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева, завершенный электронный слой, валентный слой, энергетические уровни, правило октета, орбиталь,
Электронная оболочка атома — это все электроны атома. Электроны в электронной оболочке атома расположены слоями. Электроны в разных слоях различаются энергией взаимодействия с ядром атома. Чем дальше от ядра находится электрон, тем меньше энергия его взаимодействия с ядром.
Вместимость электронных слоев различная. В слое № 1, или в первом слое, у всех элементов, кроме водорода, находится 2 электрона. (В атоме водорода всего 1. электрон, и он — в первом слое.) Во втором слое может находиться не больше восьми электронов. В третьем слое максимально может расположиться 18 электронов. В четвертом слое максимально бывает 32 электрона.
Завершенный электронный слой — это слой в атоме, содержащий максимально возможное для него число электронов.
Электронные слои заполняются так: сначала первый, потом второй и последующие — по мере уменьшения энергии их взаимодействия с ядром. Расположение по слоям электронов в атомах водорода, кислорода и магния:
Число электронных слоев атома равно номеру периода химического элемента в таблице Менделеева. Поэтому у атома водорода один электронный слой, у кислорода — два слоя, а у магния — три слоя.
Валентный слой — это внешний электронный слой. У водорода это 1-й слой, у кислорода — 2-й слой, у магния — 3-й слой. Валентные электроны — это электроны внешнего слоя. Внешний слой всегда содержит не больше восьми электронов. Восьми-электронный внешний слой характеризуется повышенной устойчивостью. (Это — «правило октета».)
Зная максимальное число электронов в каждом электронном слое атома, можно составить схему расположения электронов по слоям в заданном элементе. Электронные слои атомов называют энергетическими уровнями.
Химические свойства атомов определяются свойствами их электронов. Движение электронов в атоме описывают с привлечением понятия орбитали. Каждый электрон в атоме находится на своей орбитали.
Орбиталь — это часть электронного облака, создаваемого электронами при движении в атоме. Орбиталь — это пространство около ядра, где чаще всего находится электрон.
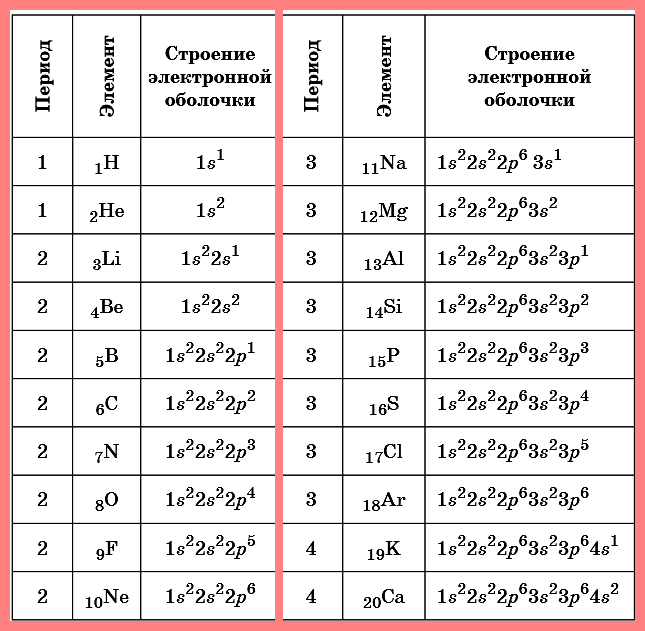
Таблица. Строение электронных оболочек атомов
первых 20 элементов Периодической системы Д.И. Менделеева
Фтор — элемент 2-го периода, т.к. в его электронной формуле два электронных слоя. Сумма всех надстрочных индексов — 9 (общее число электронов), это и атомный номер фтора. Элементы, у которых очередные электроны помещаются на s- и р-орбиталях, относятся к главным подгруппам таблицы Менделеева. Сумма электронов 2-го внешнего слоя дает номер группы — VII.
Конспект урока «Строение электронных оболочек атомов».
Строение атома. Гибридизация орбиталей
Обычно в начале статьи пишут краткий план того, о чем пойдет речь в статье. Еще добавляют зачем и почему на нее нужно тратить время. Но здесь такого не будет, потому что я не уверен — нужна ли она вообще.
Но я расскажу историю. Вообще статья должна была быть про белок, как формируется первичная, вторичная структура, ну и так далее. И вот идет подготовка материала, а там довольно большую роль играет электроотрицательность. На самом деле не очень и большую, но все-таки роль у нее есть. И вот мне стало интересно, а как она формируется? Ты конечно знаешь, что она растет в периодической таблице слева направо и зависит от радиуса атома. Но почему? В общем-то эти вопросы привели меня к строению атома и закону Кулона. Поэтому сейчас мы устроим маленькое путешествие в химию и физику. Начнем со строения атома. А уже в следующей статье будем разбираться с электроотрицательностью.
Планетарная модель строения атома от Резерфорда
Это модель ключевая, потому что на ее основе строились все остальные. Вообще Резерфорд крутой мужик, который очень любил всякие опыты. Вот один из них:
Какие выводы делает Резерфорд из этого опыта? Он предполагает, что основная масса атома сосредоточена в его ядре — когда альфа-частицы попадают в него, то отскакивают в обратную сторону. Ядро очень маленькое и заряжено положительно, а вокруг него по орбитам летают отрицательно заряженные электроны. Он называет это планетарной моделью. Очень красиво, согласитесь? Мы живем в мире, который находится в солнечной системе. А атомы, из которых состоит все вокруг, имеют строение такой же системы.
Это все очень поэтично и красиво, но есть парочка проблем:
Были и еще проблемы, но это основные. Как же их решить?
Полуклассическая модель атома по Бору
Появляется второй крутой мужик. Может быть, он даже круче первого, потому что говорит такое — от чего волосы у физиков встают дыбом. Бор взял модель атома по Резерфорду и сказал что-то вроде: «Давайте предположим, что электроны движутся по орбитам, но никакую энергию они не излучают. Но если электрон перепрыгивает с одной орбиты на другую, то он выделяет энергию — фотоны. Это и есть спектр!»
Бор назвал состояние атома, когда его электроны движутся по свои орбитам, стационарным состоянием. При перепрыгивании одного электрона на другую орбиту атом становится возбужденным и может выделять энергию. Атом становится возбужденным не просто так — он поглощает какую-то энергию извне, она представляет собой фотон или фотоны.
Переведем Бора на язык физиков: “Вся ваша физика полная туфта. Атому на нее плевать, он живет по другим законам”. И все как бы в шоке, но больше всех Эйнштейн — он становится главным хейтером Бора. Но экспериментально модель Бора подтверждается.
Модель Бора чем-то похожа на дом. Представьте себе панельку. Если электрон упадет с 7 этажа на первый, то он выделит энергию — это и есть фотон. А вот если зарядить как следует атом, то электрон может прыгнуть с первого этажа на пятый. Чем больше зарядишь, тем выше прыгнет. Чем с большей высоты упадет, тем больше выделит энергии. Примерно так. Оказалось, что Бор был прав и дальше мы это увидим.
Резерфорд, кстати, сделал предположение, что ядро состоит из положительно заряженных протонов. Но Резерфорд и Бор еще не знали, от чего зависит количество электронов и протонов, но с этим разберутся попозже.
Современная модель атома
Ну а дальше началось самое интересное — физики взяли модель атома по Бору и добавили к ней своего добра. Так получилась современная модель атома. Конец! Ну или не совсем. Атом состоит из ядра и электронной оболочки. Начинаем с ядра.
Ядро атома
У атома есть ядро, которое состоит из протонов и нейтронов. Протоны заряжены положительно, а у нейтронов заряда нет. Количество протонов и электронов равно — зависит от порядкового номера в таблице Менделеева. Если это атом азота, то у него 7 протонов и 7 электронов. Нейтрон такому правилу не подчиняется — их может быть больше, а может и меньше. Протон и нейтрон весят в примерно 1800 раз больше, чем электрон. Поэтому основная масса атома находится в ядре.
На самом деле протон и нейтрон состоят из других частиц, но не будем слишком глубоко копать. Можешь почитать, если интересно.
Электронная оболочка
Электронная оболочка — это все электроны атома. Она состоит из слоев, на которых располагается какая-то часть электронов.
Каждый слой состоит из орбиталей. Заметили? Не орбит, а орбиталей. Орбита — это траектория движения тела, на которой в какой-то момент времени можно его встретить. Помните круговые поливалки в деревне? Вода из них движется по определенной траектории. Можно встать и подождать пока тебя польют в жаркий день. Орбиталь — это другое дело, на ней электрон проводит 90 процентов времени, но как он там движется — одному ему известно. Поэтому можно стоять очень долго, но так и не дождаться пока тебя польют. Пример не очень, согласен. Лучше бы привел Луну или какую-нибудь планету, но вы поняли…
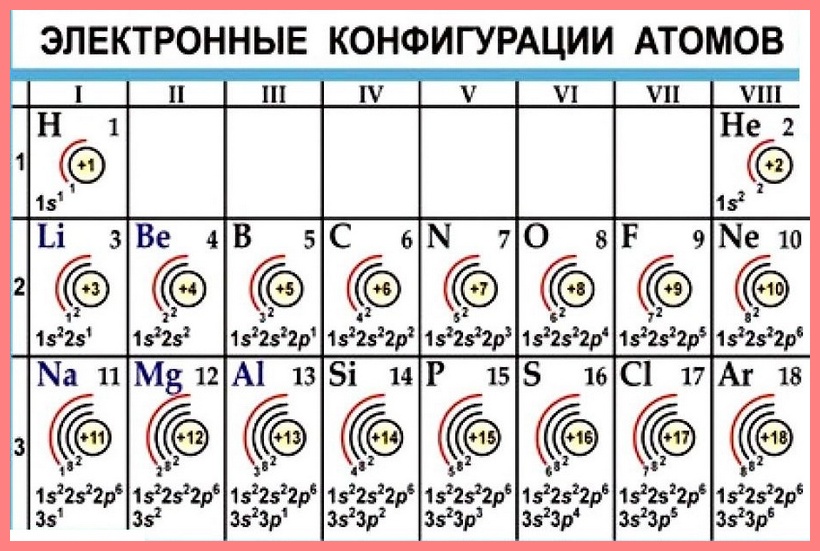
Есть 4 вида орбиталей: s, p, d и f. S- это сфера, p — бесконечность или гантелька, d и f сложнее. Я их рисовать не буду, потому что они нас не интересуют. P-орбиталей всегда 3 — px, py, pz.
Слои электронной оболочки
Теперь подробнее про слои. Первый слой состоит только из одной орбитали — s. Второй слой: одна s и три p орбиталей. Третий слой — одна s, три p и пять d орбиталей. Ну а на четвертом за 5d орбиталями добавятся еще 7f. Количество слоев зависит от количества электронов, а значит от порядкового номера атома.
Тут есть определенные правила:
Добавим к атому лития, который я показывал до этого, орбитали и получим что-то такое.
Можно еще попробовать свести орбитали в один рисунок, смотрите.
Химические связи чаще всего образуются за счет неспаренных электронов, но подробнее об этом поговорим в следующей статье. А сейчас нас интересует углерод и гибридизация его орбиталей.
Гибридизация орбиталей
Сначала посмотрим на электронную формулу углерода и вспомним о Боре. В стационарном состоянии у углерода всего два электрона на 2p-орбиталях. Однако, если атом углерода поглотит энергию фотона, то электрон с 2s-орбитали может перейти на 2p-орбиталь — атом углерода становится возбужденным. В таком состоянии он может образовать 4 связи, т.к. у него 4 неспаренных электрона.
И тут встал вопрос. Атом углерода в возбужденном состоянии может образовать четыре связи, так как у него четыре неспаренных электрона. Но энергия связей будет разной, потому что эти электроны располагаются на разных орбиталях (у p орбитали энергия побольше). Это не очень хорошо сказывается на стабильности системы. Как выйти из этого положения? Атом придумал интересную штуку — он изменил форму и размеры орбиталей. Это и есть гибридизация.
У азота есть одна неподеленная электронная пара на втором энергетическом слое, а именно на 2s-орбитали — там находится два электрона и третий туда уже не засунуть. Но азот может отдать протону водорода один электрон по донорно-акцептерному механизму и образовать связь. Так возникает ион аммония. Такая же тема с водой, но кислород не может отдать по электрону от каждой электронной пары — только с одной! Так образуется ион гидроксония.
sp 2 и sp-гибридизация
Куда пропала p-связь? Ну ладно, держите формулу этилена со всеми связями.
На рисунке видно, что p-орбитали без гибридизации находятся над и под плоскостью, они образуют сигма-связь — эта связь более жесткая, чем пи-связь. Поэтому вращение вокруг нее ограничено.
sp-гибридизацию нарисовать не смогу, сорян. Но смысл вы поняли: без изменений останутся две p-орбитали, а две sp-орбитали будут похожи на палочку — угол между ними будет 180 градусов. Одна p-орбиталь будет идти над плоскостью, а другая смотреть в лицо. Надеюсь, что у тебя получилось представить. Едем дальше.
Атомный остов
Электронный слой бывает завершенным или незавершенным:
Заряд ядра атома (количество протонов) + заряд завершенных слоев (количество электронов) = атомный остов. Картинка….
У кислорода заряд атомного остова больше, чем у натрия. Это нам понадобится, когда будем считать электроотрицательность.
Фух, со строением атома закончили. Поздравляю всех, кто дочитал до этого момента. Дальше можно переходить к электроотрицательности, но это уже в следующей статье.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.
Как устроена электронная оболочка атома что такое электронный слой атома
На этом уроке вы узнаете, как устроена электронная оболочка атома, и сможете объяснить явление периодичности. Познакомитесь с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
I. Состояние электронов в атоме
Выдающийся датский физик Нильс Бор (Рис. 1) предположил, что электроны в атоме могут двигаться не по любым, а по строго определенным орбитам.
При этом электроны в атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие – слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки. Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются электронные слои.
Каждый электронный слой состоит из электронов.
Электрон вращается вокруг ядра атома с невообразимой скоростью. Так, за 1 секунду он делает столько оборотов вокруг ядра атома, сколько оборотов делает пропеллер самолета вокруг оси за 5–5,5 лет непрерывной работы двигателя. Пропеллер самолета образует «облако», находящееся в одной плоскости, а электрон образует объемное облако –электронное облако, форма и размер которого зависят от энергии электрона.
Если обозначить точками все вероятные места нахождения электрона в атомном пространстве за некоторое время, то совокупность этих точек будет представлять собойэлектронное облако.
II. Электронное облако
Электронное облако – это модель, которая описывает состояние (движение) электрона в атоме.
Электронное облако не имеет строго очерченных границ и плотность его неравномерна.
Часть атомного пространства, в котором вероятность нахождения электрона наибольшая (
90%), называется орбиталью.
Виды электронных орбиталей
Форма орбитали в пространстве
Количество орбиталей в атоме.
Условное обозначение орбитали – клетка:
(электронное облако s – электрона)
Электронное облако такой формы может занимать в атоме одно положение
(электронное облако p – электрона)
Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z.
(электронное облако d – электрона)
(электронное облако f – электрона)
Электронное облако такой формы может занимать в атоме семь положений.
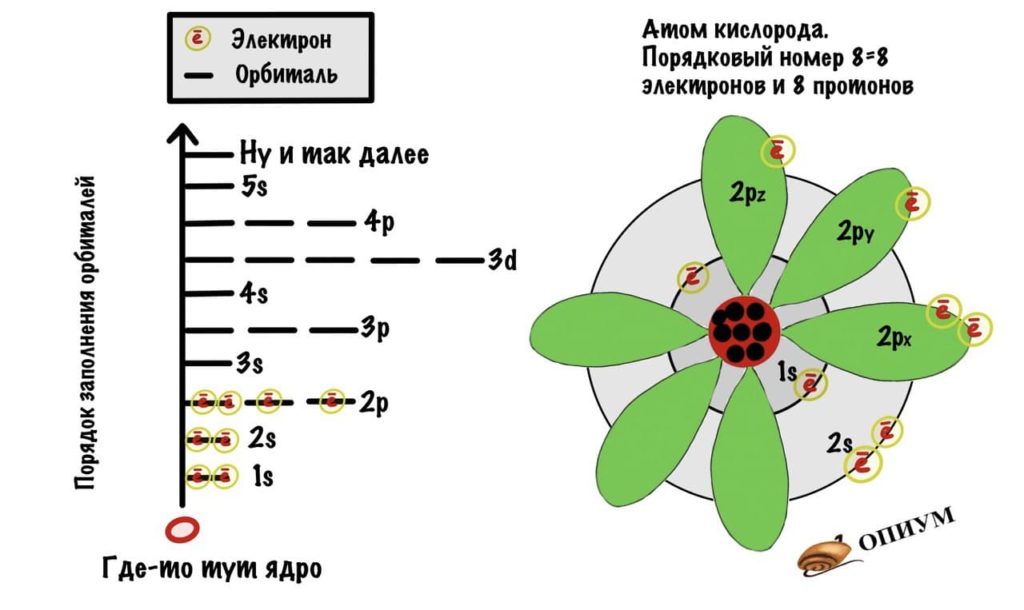
Число электронов в атоме определяют по порядковому номеру
О – 8 электронов, S – 16 электронов.
На одной орбитали могут находиться только ДВА электрона, которые вращаются вокруг своей оси в противоположных направлениях (по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами:
Cледовательно, на s – орбитали максимально может разместиться два электрона (s 2 ); на p – орбитали максимально может разместиться шесть электронов (p 6 ) на d – орбитали максимально может разместиться десять электронов (d 10 ); f – четырнадцать электронов (f 14 ).
Располагаясь на различных расстояниях от ядра, электроны образуют электронные слои (энергетические уровни) – каждому слою соответствует определённый уровень энергии.
Число энергетических уровней определяют по номеру периода, в котором находится химический элемент
О – 2 уровня, S – три уровня.
Для элементов главных подгрупп (А) число электронов на внешнем уровне = номеру группы.
+15P – V группа (А) – на внешнем уровне 5 электронов
Для элементов побочных подгрупп (В) число электронов на внешнем уровне = двум.
Исключения (один электрон) – хром, медь, серебро, золото и некоторые другие.
III. Формулы отражающие строение атомов первого и второго периодов
– схема строения атома, отображает распределение электронов по энергоуровням.
+1 Н 1s 1
– электронная формула, отображает число электронов по орбиталям.
— электронно-графическая формула – показывает распределение электронов по орбиталям и отображает спин электрона.
У элементов второго периода начинается заполнение второго энергетического уровня — он включает восемь электронов (n = 2, N = 8). Второй период содержит восемь элементов. У неона, элемента, завершающего второй период, первый и второй энергетические уровни оказываются целиком заполненными.
IV. Распределение электронов по энергетическим уровням элементов третьего и четвертого периодов ПСХЭ
1. Порядок заполнения уровней и подуровней электронами
Электронные формулы атомов химических элементов составляют в следующем порядке:
Порядок заполнения электронами атомных орбиталей определяется :
Принципом наименьшей энергии
Шкала энергий:
1s внешнего энергетического уровня, называются s-элементами. Это первые 2 элемента каждого периода, составляющие главные подгруппы I и II групп.
Элементы, в атомах которых электронами заполняется p-подуровень внешнего энергетического уровня, называются p-элементами. Это последние 6 элементов каждого периода (за исключением I и VII), составляющие главные подгруппы III—VIII групп.
Элементы, в которых заполняется d-подуровень второго снаружи уровня, называются d-элементами. Это элементы вставных декад IV, V, VI периодов.
Элементы, в которых заполняется f-подуровень третьего снаружи уровня, называются f-элементами. К f-элементам относятся лантаноиды и актиноиды.
В третьем периоде происходит заполнение третьего энергетического уровня. Третий уровень (n = 3) может максимально вмещать 18 электронов. Однако элементов в третьем периоде всего восемь. К концу третьего периода (у аргона) полностью заполняются 3s- и 3p-подуровни, а 3d-подуровень остается пустым, поэтому третий уровень не заполняется до конца.
В четвертом периоде у первых двух элементов (калия и кальция) электроны идут на четвертый энергетический уровень (4s-подуровень), а затем у последующих десяти элементов (от скандия до цинка) завершается заполнение третьего энергетического уровня (3d-подуровня).
«Проскок» или «провал» электрона
Особо следует отметить палладий, у которого «проваливаются» два электрона:
Pd1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 0 4d 10
V. Тест
Решите тестовые задания (один верный вариант ответа).
1. Заряд ядра атома фосфора равен
2. Количество энергоуровней в атоме равно
а) порядковому номеру элемента;
в) заряду ядра атома;
3. Число нейтронов в атоме цинка равно
4. В ряду элементов Na, Mg, Al, Cl металлические свойства
г) сначала убывают, а затем возрастают
5. Формула высшего оксида RO2 характерна для
6. Электронная формула строения атома меди, это-
а) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 ;
б) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9 ;
в) 1s 2 2s 2 2p 6 3s 1 3p 6 4s 2 3d 10 ;
7. Заряд ядра атома кальция равен
8. Число электронов на внешнем энергоуровне для элементов главных подгрупп равно
в) порядковому номеру элемента;
9. Число нейтронов в атоме железа равно
10. В ряду элементов C, Si, Ge, Sn способность отдавать валентные электроны
г) сначала увеличивается, а затем уменьшается.
11. Формула летучего водородного соединения для элемента с электронным строением атома 1s22s22p2 – это
12. Электронная формула строения атома мышьяка, это-
а) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 11 4p 3 ;
б) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9 4p 4 ;
в) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 4p 4 ;