Какая реакция указывает на то что фенол является кислотой
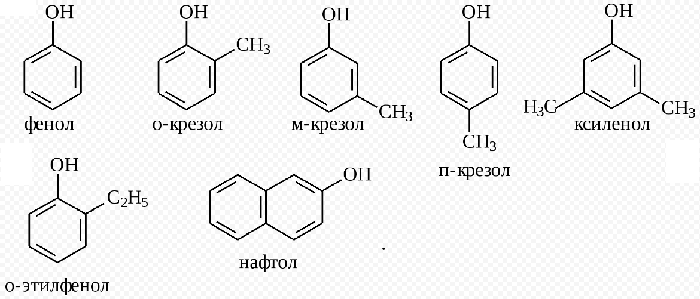
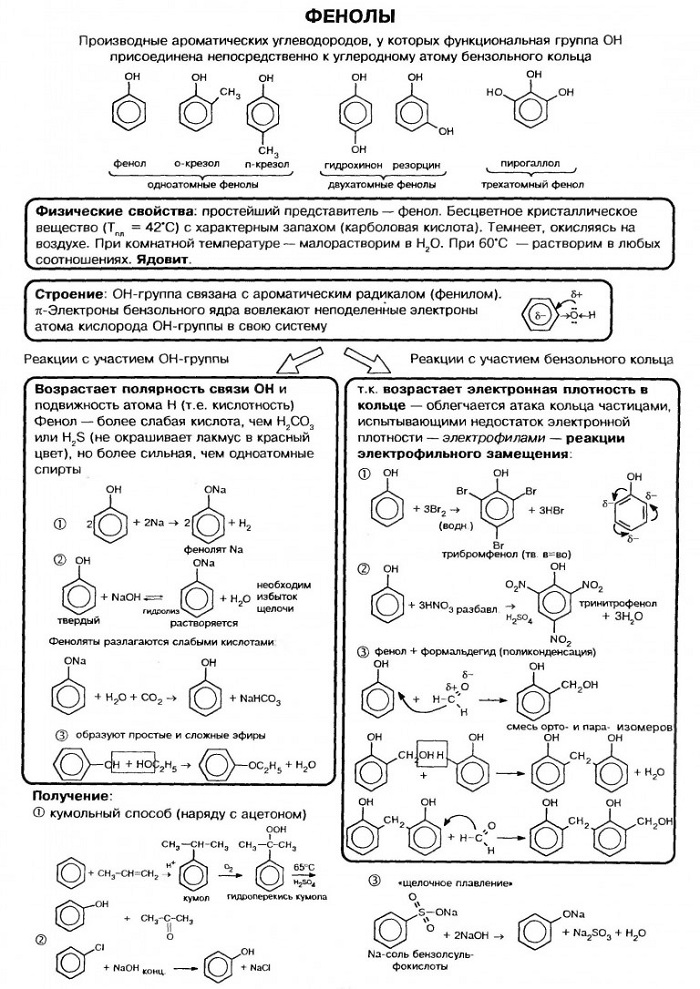
Фенолы
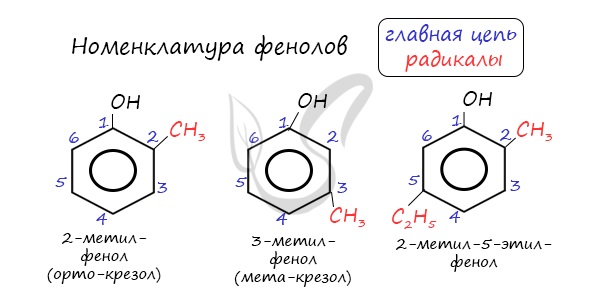
Номенклатура фенолов
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название «фенол».
Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования, нитрования протекают в орто- и пара-положениях.
Получение фенолов
При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена.
Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению, в результате получается фенол и ацетон.
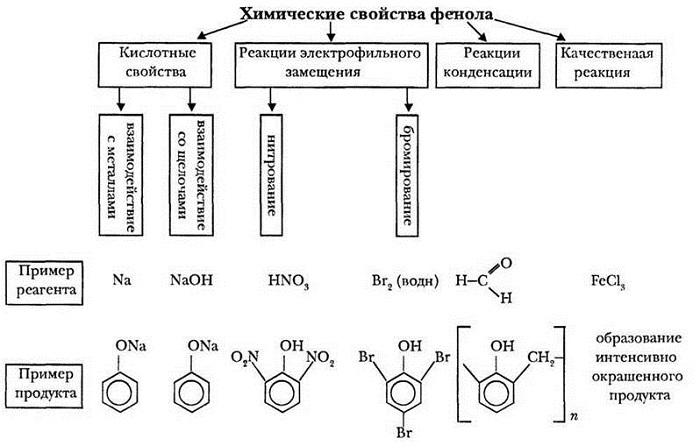
Химические свойства фенолов
При гидрировании разрываются двойные связи бензольного кольца, образуется циклогексанол.
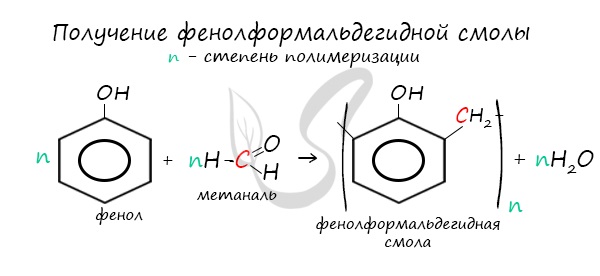
В промышленности получила широкое распространение реакция поликонденсации фенола с формальдегидом, приводящая к образованию смолообразных полимеров (фенолформальдегидные смолы) и воды.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация фенолов
По числу гидроксильных групп:
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Химические свойства фенолов
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
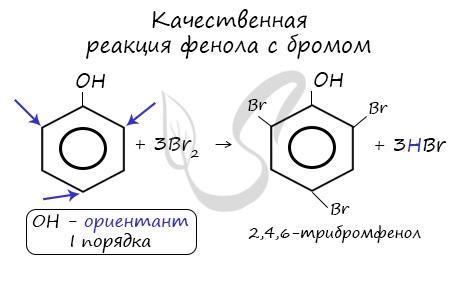
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Получение фенолов
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
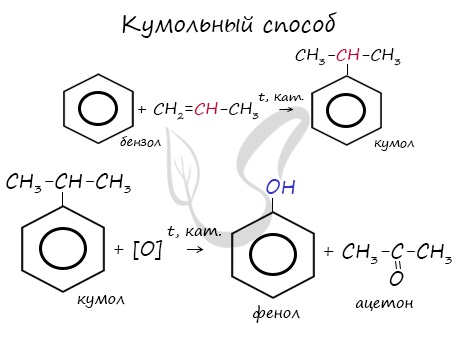
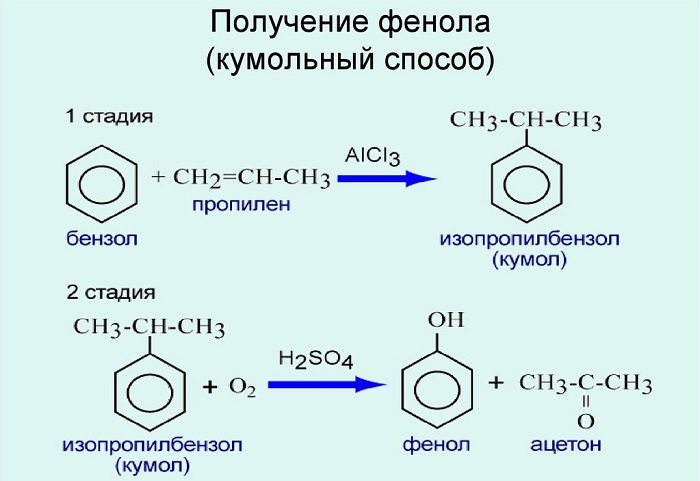
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Фенолы — номенклатура, получение, химические свойства
Фенолы — органические вещества,молекулы которых содержат радикал фенил,связанный с одной или несколькими гидроксогруппами. Так же как и спирты, фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:
Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:
Существуют и многоатомные фенолы, содержащие три и более гидроксильных групп в бензольном кольце.
Физические свойства фенола
Фенол-твердое, бесцветное кристаллическое вещества, t°плавления=43°С, t°кипения=181°С, с резким характерным запахом.Ядовит.Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой.При попадании на кожу он вызывает ожоги,поэтому с фенолом нужно обращаться очень осторожно!
Химические свойства фенола
Кислотные свойства фенола
Атом водорода гидроксильной группы обладает кислотным характером. Т.к. кислотные свойства у фенола выражены сильнее, чем у воды и спиртов, то фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов:
Кислотность фенолов зависит от природы заместителей (донор или акцептор электронной плотности), положения относительно ОН-группы и от количества заместителей. Наибольшее влияние на ОН-кислотность фенолов оказывают группы, расположенные в орто- и пара-положениях. Доноры увеличивают прочность связи О-Н (тем самым уменьшая подвижность водорода и кислотные свойства), акцепторы уменьшают прочность связи О-Н, при этом кислотность возрастает:
Однако кислотные свойства у фенола выражены слабее, чем у неорганический и карбоновых кислот. Так, например, кислотные свойства фенола примерно в 3000 раз меньше,чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол.
Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:

Качественная реакция на фенол
Фенол реагирует с хлоридом железа (3) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах.Другие фенолы,содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа(3).
Реакции бензольного кольца фенола
Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:
Эта реакция, так же как и реакция с хлоридом железа(3), служит для качественного обнаружения фенола.
2. Нитрирование фенола также происходит легче, чем нитрирование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и пароизомеров нитрофенола:
При использовании концентрированной азотной кислоты образуется 2,4,6, тринитритфенол-пикриновая кислота, взрывчатое вещество:
3. Гидрирование ароматического ядра фенола в присутствии катализатора проходит легко:
4. Поликонденсация фенола с альдегидами, в частности, с формальдегидом происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:
В молекуле димера сохраняются «подвижные» атомы водорода, а значит,возможно дальнейшее продолжение реакции при достаточном количестве реагентов:
Реакция поликонденсаци, т.е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта(воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:
Образование линейных молекул происходит при обычной температуре. Проведение этой же реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде.В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимера на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению,действию воды, щелочей, кислот.Они обладают высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин,полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы,сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе.Таким образом, фенол и продукты на его основе находят широкое применение.
Получение фенола
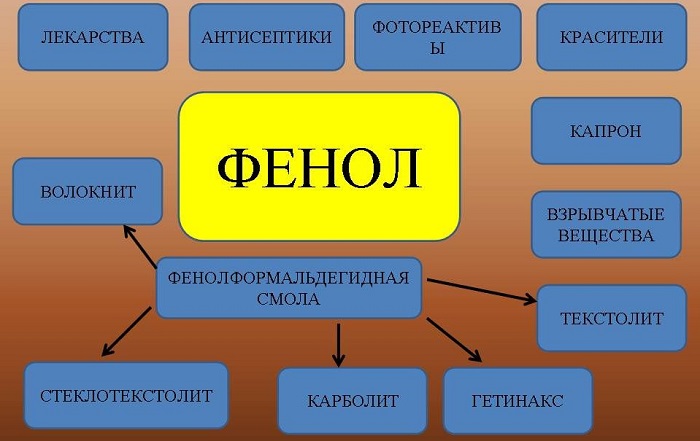
Применение фенолов
Фенол — твердое вещество, с характерным запахом, вызывает ожоги при попадании на кожу. Ядовит. Растворяется в воде, его раствор называют карболовой кислотой (антисептик). Она была первым антисептиком введенным в хирургию. Широко используется для производства пластмасс, лекарственных средств (салициловая кислота и ее производные), красителей, взрывчатых веществ.
Фенолы – органические соединения. Они в небольших количествах есть в природе. Основную массу фенола и производных на его основе получают синтетическим путём.
Что такое фенол
К фенолам относят производные ароматических углеводородов, в молекулах которых гидроксильные группы связаны с фенил радикалом. Они могут иметь одну или несколько гидроксогрупп.
Самым простым представителем этой группы соединений считают фенол. Он и дал название классу веществ. Это же соединение называют гидроксибензолом.
Общая и структурная формулы
Простейший представитель класса имеет 1 гидроксогруппу. Его молекулярная формула С6Н5ОН. Структурная формула — ОН.
Если в молекуле фенола 1 атом водорода заместить на метильный радикал, получим метилфенол. Если к нему прибавить ещё одно бензольное ядро, получим нафтол.
Химические свойства фенола
Так как гидроксибензол содержит в своём составе 2 группы атомов, выделяют две группы химических свойств.
Свойства, идущие за счет фенил радикала:
Свойства, протекающие за счёт гидроксильной группы (кислотные свойства):
взаимодействие с активными металлами;
взаимодействие со щелочами.
Не следует понимать, что фенол, имея в своем составе черты строения бензола и спиртов, просто повторяет их свойства. На самом деле все сложнее. Чтобы понять особенность его химических взаимодействий, необходимо знать строение вещества. В молекуле фенола наблюдается взаимное влияние атомов.
На атоме кислорода гидроксильной группы есть 2 неподелённые электронные пары. Они взаимодействуют с π – электронной системой фенил радикала.
Результат взаимодействия следующий:
Нарушается равномерное распределение электронной плотности в фенил радикале. Она возрастает на атомах 2,4,6, то есть в орто– и параположениях. Именно в этих положениях водород будет легко замещаться на другие атомы.
Атом водорода гидроксогруппы, из-за влияния фенил радикала, приобретает положительный заряд и становится более подвижным.
Результатом влияния служат своеобразные свойства фенола. Он реагирует с активными металлами и щелочами. Спирты – только с металлами. В то же время и бензол, и гидроксибензол реагируют с бромной водой. Но у фенола, в отличие от бензола, идет замещение сразу по 3 атомам.
Физические свойства
С6Н5ОН – это белое кристаллическое вещество. В результате окисления кристаллы могут приобретать розовый цвет. Температура плавления 40,9 0 С. Молярная масса 94 г/моль.
В холодной воде фенол является малорастворимым веществом. При температуре выше +70 0 С растворяется хорошо. Карболовая кислота – так называют водный раствор фенола. Лучше растворяется в органических растворителях.
Отличается характерным резким запахом. Вещество ядовито. Проникая в организм человека, вызывает тяжёлое отравление.
С чем реагирует фенол
Гидроксибензол вступает в реакцию с активными металлами. С натрием даёт фенолят натрия. Уравнение выглядит следующим образом:
В реакциях со щелочами также образует феноляты. Реагируя с гидроксидом калия, образует фенолят калия:
Взаимодействуя со спиртами, образует эфиры. Например, в реакции с бутанолом, получают простой эфир:
Из свойств, протекающих за счёт фенил радикала, можно отметить реакцию нитрования. Взаимодействие с HNO3 даёт 2,4,6 тринитрофенол (пикриновую кислоту):
Реагируя с формальдегидом, фенол образует фенолформальдегидную смолу. Это реакция поликонденсации – получение высокомолекулярного вещества из низкомолекулярных веществ с отщеплением побочного продукта. В данном случае – это вода.
Качественные реакции на фенол
К качественным реакциям относят взаимодействие с бромной водой. В результате получают осадок белого цвета:
Ещё одной качественной реакцией является взаимодействие с хлоридом железа(III). Получается фиолетовое окрашивание. Качественные реакции позволяют разделить и определить органические вещества.
Реакция присоединения
К реакциям присоединения относят гидрирование ароматического ядра. Гидрирование – это реакции присоединения водорода. Превращение протекает легко, в присутствии катализатора. В результате разрушается π – электронная система, образуется циклогексанол и циклогексанон:
Окисление
Фенол не устойчив к окислению. Продукты реакции могут быть разными. Это зависит от самого окислителя и от условий, в которых протекает реакция. При окислении перекисью водорода получается двухатомный фенол:
К реакции окисления относят и реакцию горения. Образуется углекислый газ и вода.
Получение фенола
Фенол в небольшом количестве содержится в каменноугольной смоле. Но потребности в веществе настолько велики, что этого источника недостаточно.
Разработаны разные способы получения:
Используют для получения бензол и пропилен, в результате чего получают кумол. Затем кумол окисляют, в результате получают ценные продукты – фенол, ацетон.
Применение
Вещество применяют для производства разнообразной продукции:
фенолформальдегидных смол и пластмасс;
раствор фенола в воде обладает антисептическими свойствами;
искусственных волокон и другой продукции.
Заключение
Фенол и фенольные соединения – очень важная группа веществ. Не следует забывать, что многие из них являются ядами. Все отходы промышленности, содержащие вещество, тщательно очищаются. Их подвергают каталитическому окислению, обработке озоном и другим способам очистки.