Карбонат химия это что
Карбонаты
В случае необходимости обсуждения целесообразности объединения, замените этот шаблон на шаблон <<к объединению>> и добавьте соответствующую запись на странице ВП:КОБ.
Карбона́ты и ги́дрокарбонаты — соли и эфиры угольной кислоты (H2CO3). Среди солей известны нормальные карбонаты (с анионом СО3 2− ) и кислые или гидрокарбонаты (с анионом НСО3 − ).
Содержание
Растворимость
Из нормальных карбонатов в воде растворимы только соли щелочных металлов, аммония и таллия. Вследствие гидролиза растворы их показывают щелочную реакцию. Малорастворимы нормальные карбонаты кальция, бария, стронция и свинца. Все кислые карбонаты хорошо растворимы в воде; кислые карбонаты сильных щелочей также имеют слабощелочную реакцию.
Химические свойства
Распространение в природе
Нормальные карбонаты широко распространены в природе, например: кальцит СаСО3, доломит CaMg(CO3)2, магнезит MgCO3, сидерит FeCO3, витерит ВаСО3, баритокальцит BaCa(CO3)2 и др. Существуют и минералы, представляющие собой основные карбонаты, например, малахит CuCO3·Cu(ОН)2.
Гидрокарбонаты натрия, кальция и магния встречаются в растворённом виде в минеральных водах, а также, в небольшой концентрации, во всех природных водах, кроме атмосферных осадков и ледников. Гидрокарбонаты кальция и магния обуславливают так называемую временную жёсткость воды. При сильном нагревании воды (выше 60 °C) гидрокарбонаты кальция и магния разлагаются на углекислый газ и малорастворимые карбонаты, которые выпадают в осадок на нагревательных элементах, дне и стенках посуды, внутренних поверхностях баков, бойлеров, труб, запорной арматуры и т. д., образуя накипь.
Применение
Карбонаты кальция, магния, бария и др. применяют в строительном деле, в химической промышленности, оптике и др. В технике, промышленности и быту широко применяется сода (Na2CO3 и NaHCO3): при производстве стекла, мыла, бумаги, как моющее средство, при заправке огнетушителей, в кондитерском деле. Кислые карбонаты выполняют важную физиологическую роль, являясь буферными веществами, регулирующими постоянство реакции крови.
Карбонаты органические
Литература
Примечания
См. также
Полезное
Смотреть что такое «Карбонаты» в других словарях:
КАРБОНАТЫ — соли и эфиры угольной кислоты Н2СО3. Различают нормальные (средние) соли с анионом CO32 (напр., К2СО3) и кислые (гидрокарбонаты) с анионом НСО3 (напр., КНСО3). Природные карбонаты нормальные соли. Из синтетических карбонатов в технике широко… … Большой Энциклопедический словарь
КАРБОНАТЫ — [от лат. carbo (carbonis) уголь], класс минералов (около 80), природные соли угольной кислоты (Н2СО3); слагают штольни осадочных (известняки, доломиты и др.) и метаморфич. (мраморы) пород. Широко распространены в коре выветривания в зоне… … Экологический словарь
Карбонаты — – соли угольной кислоты. В строительной практике широко используются карбонаты кальция и магния (СаCO3, MgCO3 ). [Пантилеенко, В. Н. Строительные материалы [Текст] : учеб. пособие / В. Н. Пантилеенко, Л. А. Ерохина, Е. М. Веряскина. – 2 е изд.,… … Энциклопедия терминов, определений и пояснений строительных материалов
КАРБОНАТЫ — КАРБОНАТЫ, соли угольной кислоты H2CO3. Широко распространены в виде минералов (известно свыше 120), играют большую роль в круговороте углекислого газа CO2 в природе. Смотри, например, Кальция карбонат … Современная энциклопедия
КАРБОНАТЫ — КАРБОНАТЫ, соли УГЛЕКИСЛОТЫ (Н2СО3), образующиеся при растворении диоксида углерода (углекислого газа, СО2) в воде, например, при выпадении дождя. Углекислота является очень слабой кислотой, и она сама, и многие ее соли неустойчивы и легко… … Научно-технический энциклопедический словарь
карбонаты — Соли угольной кислоты Н2СО3: норм. к. с анионом С032 (напр., KjCO.,), кислые к. с анионом НСО3 (напр., КНСО3) и осн. к. (напр., Сu2(ОН)2СО3 — минерал малахит). Нек рые природные, нормальные и осн. к. — весьма ценные металлич. руды: к … Справочник технического переводчика
карбонаты — – соли угольной кислоты. Словарь по аналитической химии [3] … Химические термины
Карбонаты — КАРБОНАТЫ, соли угольной кислоты H2CO3. Широко распространены в виде минералов (известно свыше 120), играют большую роль в круговороте углекислого газа CO2 в природе. Смотри, например, Кальция карбонат. … Иллюстрированный энциклопедический словарь
Карбонаты — [carbonates] соли угольной кислоты H2СO3: нормальные карбонаты с анионом СО32 (например, K2CO3,), кислые карбонаты с анионом НCO3 (например, КНСO3) и основные карбонаты (например, Cu2(ОН)2CO3 минерал малахит). Некоторые природные, нормальные и… … Энциклопедический словарь по металлургии
Содержание
Структура и склеивание
В Структура Льюиса карбонат-иона имеет две (длинные) одинарные связи с отрицательными атомами кислорода и одну короткую двойную связь с нейтральным кислородом.
Эта структура несовместима с наблюдаемой симметрией иона, что означает, что все три связи имеют одинаковую длину и что три атома кислорода эквивалентны. Как и в случае с изоэлектронный нитрат иона симметрия может быть достигнута резонанс среди трех структур:
Этот резонанс можно описать моделью с дробными связями и делокализованный сборы:

Химические свойства
Карбонаты металлов обычно разлагаются при нагревании, выделяя углекислый газ в течение длительного времени. цикл углерода к краткосрочному циклу углерода и оставлению оксида металла. [2] Этот процесс называется прокаливание, после кал, латинское название негашеной извести или оксид кальция, CaO, который получают обжигом известняка в печь для обжига извести.
Газированная вода образуется при растворении CO2 в воде под давлением. Когда парциальное давление CO2 уменьшается, например, когда банка с газированной водой открыта, равновесие для каждой из форм карбоната (карбонат, бикарбонат, диоксид углерода и угольная кислота) смещается до тех пор, пока концентрация CO2 в растворе равна растворимости CO2 при этой температуре и давлении. В живых системах фермент, карбоангидраза, ускоряет взаимное превращение CO2 и угольная кислота.
Хотя карбонатные соли большинства металлов нерастворимы в воде, этого нельзя сказать о бикарбонатных солях. В растворе это равновесие между карбонатом, бикарбонатом, диоксидом углерода и угольной кислотой постоянно меняется в зависимости от условий изменения температуры и давления. В случае ионов металлов с нерастворимыми карбонатами, такими как CaCO3, приводит к образованию нерастворимых соединений. Это объясняет накопление накипи внутри труб, вызванное жесткая вода.
Карбонат в неорганической номенклатуре
Органические карбонаты
В органическая химия карбонат также может относиться к функциональная группа внутри более крупной молекулы, содержащей атом углерода, связанный с тремя атомами кислорода, один из которых имеет двойную связь. Эти соединения также известны как органокарбонаты или сложные эфиры карбонатов и имеют общую формулу ROCOOR ‘или RR’CO3. Важные органокарбонаты включают: диметилкарбонат, циклические соединения этиленкарбонат и пропиленкарбонат, и замена фосгена, трифосген.
Буфер
Он работает как буфер в крови следующим образом: при низком pH концентрация ионов водорода слишком высока, поэтому выдыхается CO2. Это приведет к смещению уравнения влево, [ требуется дальнейшее объяснение ] существенно уменьшая концентрацию H + ионы, вызывающие более щелочной pH.
Когда pH слишком высокий, концентрация ионов водорода в крови слишком низкая, поэтому почки выделяют бикарбонат ( HCO −
3 ). Это заставляет уравнение сдвигаться вправо, существенно увеличивая концентрацию ионов водорода, вызывая более кислый pH.
Три важных обратимых реакции контролируют указанный выше баланс pH: [4]
Выдыхаемый CO2(g) истощает CO2(aq), который, в свою очередь, потребляет H2CO3, вызывая вышеупомянутый сдвиг влево в первой реакции на Принцип Ле Шателье. По тому же принципу, когда pH слишком высок, почки выделяют бикарбонат ( HCO −
3 ) в мочу в виде мочевины через цикл мочевины (или орнитиновый цикл Кребса – Хенселейта). Удалив бикарбонат, больше H + образуется из угольной кислоты (H2CO3), который исходит от CO2(g) произведено клеточное дыхание.
Что особенно важно, тот же буфер действует в океанах. Это главный фактор в изменении климата и долгосрочном углеродном цикле из-за большого количества морских организмов (особенно кораллов), которые образованы из карбоната кальция. Повышенная растворимость карбоната за счет повышения температуры приводит к снижению производства морских кальцит и повышенная концентрация углекислого газа в атмосфере. Это, в свою очередь, увеличивает температуру Земли. Тоннаж CO 2−
3 находится в геологическом масштабе и может все повторно растворяться в море и выбрасываться в атмосферу, увеличивая CO2 уровни даже больше. [ нужна цитата ]
Карбонатные соли
| ЧАС2CO3 | Он | ||||||||||||||||
| Ли2CO3, LiHCO3 | BeCO3 | B | C | (NH4)2CO3, NH4HCO3 | О | F | Ne | ||||||||||
| Na2CO3, NaHCO3, Na3H (CO3)2 | MgCO3, Mg (HCO3)2 | Al2(CO3)3 | Si | п | S | Cl | Ar | ||||||||||
| K2CO3, KHCO3 | CaCO3, Ca (HCO3)2 | Sc | Ti | V | CrCO3, Cr2(CO3)3 | MnCO3 | FeCO3 | CoCO3, Co2(CO3)3 | NiCO3 | Cu2CO3, CuCO3 | ZnCO3 | Ga | Ge | В качестве | Se | Br | Kr |
| Руб.2CO3 | SrCO3 | Y | Zr | Nb | Пн | Tc | RU | Rh | PdCO3 | Ag2CO3 | CdCO3 | В | Sn | Sb | Te | я | Xe |
| CS2CO3, CsHCO3 | BaCO3 | Hf | Та | W | Re | Операционные системы | Ir | Pt | Au | HgCO3 | Tl2CO3 | PbCO3 | (БиО)2CO3 | Po (CO3)2 | В | Rn | |
| Пт | Ра | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | |
| ↓ | |||||||||||||||||
| Ла2(CO3)3 | Ce2(CO3)3 | Pr2(CO3)3 | Nd2(CO3)3 | Вечера2(CO3)3 | См2(CO3)3 | EuCO3, Европа2(CO3)3 | Б-г2(CO3)3 | Tb2(CO3)3 | Dy2(CO3)3 | Хо2(CO3)3 | Э2(CO3)3 | Тм2(CO3)3 | Yb2(CO3)3 | Лу2(CO3)3 | |||
| Ac | Чт (CO3)2 | Па | UO2CO3 | Np | Пу | Являюсь | См | Bk | Cf | Es | FM | Мкр | Нет | Lr |
Присутствие за пределами Земли
Принято считать, что присутствие карбонатов в камень является веским доказательством наличия жидкой воды. Недавние наблюдения планетарная туманность NGC 6302 показать доказательства наличия карбонатов в космосе, [5] где водные изменения, подобные земным, маловероятны. Были предложены другие минералы, которые соответствовали бы наблюдениям.
До не давнего времени карбонатные отложения не были обнаружены на Марсе с помощью дистанционного зондирования или полевых миссий, хотя марсианские метеориты содержат небольшие количества. Подземные воды могли существовать в Гусев [6] и Meridiani Planum. [7]
Карбонат химия это что
Карбонаты — соли угольной кислоты — Н2С03. Карбонаты составляют до 1,7% веса земной коры. Блеск у них неметаллический. Все минералы, относящиеся к этому классу, имеют среднюю твердость, землистые разности являются мягкими. Исключительно характерным признаком для всего класса карбонатов является реакция с разбавленной соляной кислотой (10%-ный раствор), при этом выделяется СО2. Некоторые представители этого класса реагируют с соляной кислотой на холоде, другие же реагируют только с нагретой соляной кислотой. Наиболее характерная форма для кристаллов карбонатов — ромбоэдр (тригональная сингония). Минералы, относящиеся к этому классу, легкие. Все карбонаты дают черту. Плотность у них небольшая.
Карбонаты делятся на безводные и водные. Цвет у безводных карбонатов непостоянный, черта — постоянная. Цвет и черта у водных карбонатов постоянные, присущие только определенному минералу.
Карбонаты — компоненты многих минеральных ассоциаций, образующихся в поверхностной части земной коры. Карбонаты осаждаются на дне морей, озер, лагун, образуются при выветривании сульфидов и силикатов, выделяются из горячих и холодных подземных вод, входят в состав раковин многих беспозвоночных животных.
Карбонаты преимущественно нерудные и частично рудные полезные ископаемые. Из карбонатов состоят распространенные горные породы — известняк, доломит, мрамор.
Кальцит (известковый шпат) — CaCO 3
Физические свойства. Блеск стеклянный, перламутровый; землистый и плотный кальцит матовый. Твердость 3, землистые разности мягкие. Бесцветный, белый, реже желтый, зеленый, голубой, синий, фиолетовый, темно-бурый, черный. Черта белая. Твердость 2,5-3. У кристаллического кальцита наблюдается совершенная спайность в трех направлениях по граням ромбоэдра. Зернистые разности при ударе раскалываются по определенным направлениям и дают обломки в виде ромбоэдров. Сплошной зернистый, плотный, натёчный, пористый, землистый, листоватый, полосчатый, радиально-лучистый; также кристаллы, друзы. Кристаллы кальцита имеют различные формы. Сингония тригональная. Иногда дает ложные формы по другим минералам.
Отличительные признаки. Кальцит имеет неметаллический блеск, среднюю твердость или мягкий, бурно вскипает при действии разбавленной соляной кислотой или уксусом. Кальцит можно спутать с доломитом и магнезитом. Отличие—доломит реагирует с разбавленной соляной кислотой только в порошкообразном виде, магнезит—с нагретой соляной кислотой. Похожий на него ангидрит не реагирует с разбавленной соляной кислотой.
Химические свойства. Бурно вскипает при действии разбавленной соляной кислоты. Вскипает при действии уксусом.
Разновидности. Прозрачный, двупреломляющий кальцит (удваивает рассматриваемое через него изображение) называется исландским шпатом, очень тонкозернистый кальцит — литографским камнем, листо ватый кальцит — бумажным шпатом. Разновидностью кальцита также является жемчуг (перл). Еще одна разновидность кальцита — мраморный оникс.
Физические свойства. Химический состав такой же, как у кальцита. Сингония ромбическая. Облик кристаллов призматический, часто псевдогексагональный, игольчатый. Кристаллическая структура арагонита более плотная, чем у кальцита, что ведет к разнице в плотности. Агрегаты волокнистые, скорлуповатые, плотные, оолитовые. Цвет белый, серый, бледно-желтый, иногда светло-зеленый, фиолетовый и серый. Черта белая, светло-серая. Блеск стеклянный, в изломе жирный. Твердость 3,5-4. Плотность 2,95-3,0 (большая, чем у кальцита).
Физические свойства. Блеск стеклянный, перламутровый. Твердость средняя. Цвет белый, желтый, серый, зеленоватый, черный. Черта белая. У кристаллического доломита совершенная спайность в трех направлениях по граням ромбоэдра. Сплошные зернистые мраморовидные или плотные массы. Кристаллы имеют форму ромбоэдров. Сингония тригональная.
Отличительные признаки. Для доломита характерны неметаллический блеск, средняя твердость и вскипание порошка доломита при действии разбавленной соляной кислоты. Доломит похож на кальцит. Отличается тем, что кальцит бурно реагирует с разбавленной соляной кислотой.
Химические свойства. Порошок вскипает при действии разбавленной соляной кислоты.
Магнезит (магнезиальный шпат) — MgCO 3
Отличительные признаки. Для магнезита характерны неметаллический блеск, средняя твердость и вскипание порошка магнезита при действии нагретой соляной кислоты. Этим магнезит отличается от сходных с ним минералов — кальцита, доломита. От сидерита отличается по цвету.
Сидерит (железный шпат) — FeC 03.
Физические свойства. Блеск стеклянный, или сидерит матовый. Твердость средняя. Цвет желтовато-серый, желтовато-бурый, бурый. Черта белая, иногда буроватая. У кристаллических разностей наблюдается совершенная спайность в трех направлениях по граням ромбоэдра. Сплошной зернистый, мраморовид ный, плотный, натёчный, землистый, шаровидный, ради ально-лучистого строения внутри (сферосидериты), также кристаллы в виде ромбоэдров или друзы. Сингония тригональная.
Отличительные признаки. Для сидерита ха рактерны неметаллический блеск, средняя твердость, желтый, бурый цвет, белая черта и вскипание при действии нагретой соляной кислоты. Сидерит похож на крупнозернистый желтоватый или коричневатый мрамор.
Химические свойства. Вскипает при действии нагретой соляной кислоты. Капля соляной кислоты, помещенная на поверхности сидерита, благодаря образованию FeCl 3 желтеет.
Физические свойства. Блеск стеклянный, шел ковистый или малахит матовый. Твердость средняя, зем листые разности мягкие. Цвет ярко-зеленый, травяно- зеленый. Малахиту придает красоту ярко-зеленый цвет, затейливый рисунок, нередко создающий загадочные картины, причудливые узоры, концентрическое, полосчатое и радиально-лучистое строение. Черта бледно-зеленая. Натечный, радиально-лучистый, концентрически- скорлуповатый, плотный землистый; редко кристаллы игольчатой формы. Сингония моноклинная.
Отличительные признаки. Постоянными при знаками для малахита являются зеленый цвет и вскипа ние при действии разбавленной соляной кислоты. Спутник — азурит (синий, вскипает при действии соля ной кислоты).
Химические свойства. Вскипает при действии разбавленной соляной кислоты.
Разновидность. Медная зелень — землистый, мягкий малахит.
Происхождение. Образуется малахит в результате химического выветривания медьсодержащих минералов (халькопирита, меди самородной и др.) под действием углекислоты, воды и кислорода. Медьсодержащие сульфиды превращаются в сульфаты, а затем под действием углекислых растворов в малахит.
Карбонат химия это что
Ключевые слова конспекта: ионные соединения, карбонаты, силикаты, сода, гидролиз, гашение соды, приготовление теста.
Как и большинство солей, карбонаты и силикаты можно отнести к ионным соединениям.
Формулы для силикатов Men(SiO3)m отражают только соотношение элементов, но не истинный состав силикат-анионов, который, как и в случае с кремниевой кислотой, более сложен.
При обычных условиях карбонаты и силикаты – твёрдые вещества, бесцветные, если катион металла не даёт характерную окраску. В воде растворимы только карбонаты и силикаты щелочных металлов (кроме Li) и (NH4)2CO3. Гидрокарбонаты металлов, в которых катионы имеют заряд 2+, как правило, лучше растворимы в воде, чем карбонаты.
Химические особенности карбонатов и силикатов
Na2CO3 + H2O ⇆ NaHCO3 + NaOH
CO3 2– + H2O ⇆ НСО3 – + OH –
При обычных условиях гидролиз протекает преимущественно по I ступени.
В быту часто проводится реакция гашения соды, когда готовят тесто. Питьевую соду NaHCO3 обрабатывают уксусом (раствором уксусной кислоты):
NaHCO3 + СH3СООН = CH3COONa + CO2↑ + H2O
НСO3 – + СH3СООН = CO2↑ + H2O + CH3COO –
В этой реакции уксусная кислота вытесняет из соли слабую и летучую угольную кислоту, которая разлагается на углекислый газ и воду. Образующийся углекислый газ поднимает тесто.
С сильными кислотами взаимодействуют и растворимые силикаты, при этом образуется гель кремниевой кислоты переменного состава. Условно этот процесс можно отразить с помощью ионного уравнения:
S1O3 – + 2Н + = H2SiO3↓
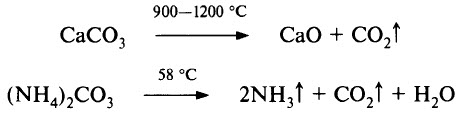
Более устойчивы к нагреванию карбонаты щелочных металлов, они плавятся без разложения (кроме Li2СO3) при 800–900 °С и разлагаются при температуре около 1000 °С. Вообще, термическая устойчивость карбонатов изменяется в широких пределах. Например, ВеСО3 разлагается при температуре ниже 100 °С, а у ВаСO3 полная диссоциация наблюдается при 1300 °С.
Наиболее известными карбонатами являются: Na2CO3 – сода кальцинированная, Na2CO3 • 10H2O – сода кристаллическая, К2СО3 – поташ. Соединение MgCO3 образует минерал магнезит, а СаСО3 – известняк, мел, мрамор, кальцит (исландский шпат), (СuОН)2СО3 образует малахит. Концентрированный раствор силиката натрия Na2SiO3 используется как силикатный клей.
Конспект урока по химии «Карбонаты и силикаты». Выберите дальнейшее действие:
Ещё конспекты по теме «Углерод и кремний«: