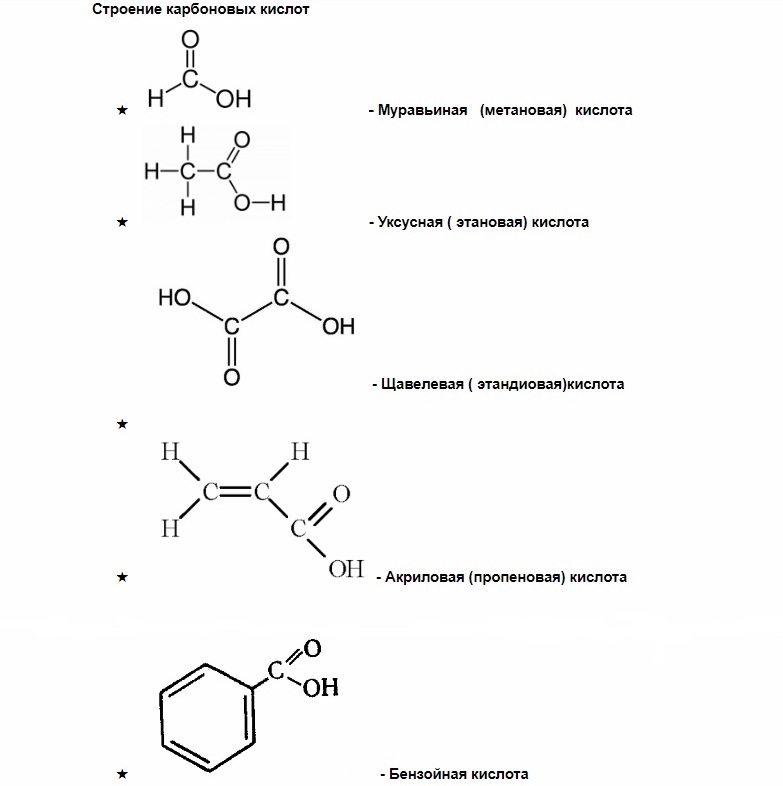
Карбоновая кислота чем опасна
Карбоновые кислоты
Карбоксильная группа, в свою очередь, делится на карбонильную группу С=О и гидроксильную группу О-Н.
Карбоновые кислоты — группа органических веществ, в состав которых входят одна или несколько карбоксильных групп и углеводородный радикал (алкил).
Как вы можете заметить, у муравьиной кислоты одна группа СООН, у щавелевой две, а у лимонной – целых три.
По количеству карбоксильных групп карбоновые кислоты делятся на
В зависимости от структуры углеводородного радикала карбоновые кислоты делятся на
насыщенные — (муравьиная, щавелевая) — все связи углерода одинарные.
ненасыщенные (олеиновая, линолевая) — в составе радикала, между атомами углерода есть двойные связи.
ароматические (бензойная) — в составе радикала есть бензольное кольцо. Хотя имеют специфический запах все карбоновые кислоты, эта группа особенно ароматна.
Номенклатура карбоновых кислот.
Некоторые карбоновые кислоты имеют свои народные или тривиальные названия: муравьиная, уксусная, лимонная и т.д.
Также есть официальное название кислоты в зависимости от углеводородного радикала.
Для того, чтобы правильно назвать карбоновую кислоту, нужно:
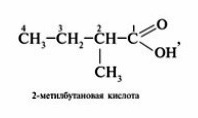
1.Определить и пронумеровать самую длинную (главную) углеродную цепочку, считая от атома карбоксильной группы.
2. Назвать согласно номенклатуре углеводород (как это сделать, можно посмотреть в учебнике Химия.10 класс под редакцией Габриеляна на портале LECTA)
Получение карбоновых кислот
Первой открыли и начали использовать уксусную кислоту. Как и большинство открытий, произошло это случайно. Содержимое одной из винных бутылок, простояв дольше нужного времени, превратилось из вина в уксус.
На языке науки эта несложная реакция называется окислением спиртов.
Поскольку большинство из карбоновых кислот входят в состав природных продуктов, до сих пор около 30% получают из биологических объектов.
Однако карбоновые кислоты активно используются в фармацевтической, кожевенной, металлообрабатывающей промышленности и получать их химическим путем быстрее и дешевле. Одно дело год ждать превращения уксуса в вино, и совсем другое — окислить подходящий углеводород, добытый на месторождении полезных ископаемых.
Муравьиная кислота — в ряду карбоновых кислот эта самая скромная кислота с единственным атомом углерода в структуре обладает уникальными свойствами за счет одновременного присутствия в структуре карбонильной и карбоксильной групп.
При реакции муравьиной кислоты с аммиачным раствором оксида серебра образуется блестящий осадок — реакция серебряного зеркала.
HCOOH + Ag2O (аммиачный раствор) 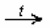
Больше интересных материалов:
Способы получения карбоновых кислот в химической промышленности
1. При помощи различных катализаторов (оксид серебра, перманганат калия) окислить подходящий альдегид
2 RCHO + O2 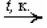
2. При помощи катализатора провести реакцию окисления спиртов
RCH2OH + O2 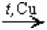
3. При помощи окисления различных углеводородов (алкинов, алкенов, алкилбензолов) можно получить соответствующие карбоновые кислоты.
2 C4H10 + 5O2 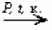
Физические свойства карбоновых кислот
Поскольку, карбоновые кислоты довольно разнородная группа веществ, говорить об общих физических свойствах, характерных для всех представителей группы неправомерно.
По количеству атомов углерода, входящих в состав вещества, карбоновые кислоты делятся на:
низшие — количество атомов от 1 до 3 — (муравьиная кислота) прозрачные жидкости с характерным запахом, отлично растворяются в воде
средние — количество атомов от 4 до 9 — ( валериановая кислота) жидкости с резким, неприятным запахом. маслянистые на ощупь.
высшие — количество атомов превышает 9 — (олеиновая кислота) — твердые вещества, нерастворяются в воде.
Молекулярная масса кислоты влияет на температуры плавления и кипения.
Плотность карбоновых кислот (за исключением муравьиной и уксусной кислот) меньше единицы.
Химические свойства карбоновых кислот.
1. Карбоновые кислоты обратимо диссоциируют. Проверить это можно с помощью лакмусовой бумажки. Она покраснеет, как в растворе любой кислоты.
Чем длиннее радикал, тем меньше степень диссоциации, и тем меньше проявляются кислотные свойства.
2. Карбоновые кислоты по своей природе являются слабыми кислотами, и участвуют во всех реакциях, характерных для неорганических кислот. Реагируют с солями, металлами, оксидами и гидроксидами металлов. В результате образуются соли карбоновых соединений и вода.
Отравление препаратом кислота карбоновая
Метиловые, этиловые, пропиловые, амиловые и бензиловые эфиры простейших монокарбоновых кислот (муравьиной, уксусной, пропионовой, масляной) или бензойгюй кислоты. В основном служат растворителями и экстрагентами. Некоторые эфиры обладают ароматным запахом и применяются в качестве пахучих веществ в парфюмерии и пищевой промышленности.
Все эфиры карбоновых кислот очень летучие и токсичные соединения. При расщеплении бензилового эфира образуется нейро- и кардиотоксический бензиловый спирт, который резорбируется через кожу. Применяется бензиловый эфир как растворитель, иногда для местной анестезии.
В токсикологическом отношении имеют значение галогенэфиры карбоновых кислот. Хлор-, бром-, йодкарбоновые эфиры действуют на кожу подобно иприту. Монофлюорацетат раздражает слизистые глаз, метиловый и этиловый эфиры оксибензойной кислоты — относительно безвредные вещества, применяемые в качестве антимитотических средств и консервантов. Метиловый эфир салициловой кислоты (метилсалицилат) применяется в качестве противоревматического средства.
Клиника
Отравление эфирами карбоновых кислот возникает при интенсивном вдыхании их паров или попадании внутрь. При этом отмечается раздражение слизистых оболочек, особенно бензиловым эфиром муравьиной кислоты. Возможен отек легких.
После энтеральной и парентеральной резорбции эфиров возникает гастроинтестинальный синдром и наркотический эффект. Метиловые эфиры карбоновых кислот дают картину легкого отравления метанолом. Поздние проявления отравления — нарушение функции печени и почек.
Лечение
Промывание желудка с активированным углем и другие мероприятия — как при отравлении алкоголем. При поражении слизистых — симптоматическое лечение, внутрь — масляная анестезиновая эмульсия. При отравлении галоген-эфирами карбоновых кислот лечение нужно начинать как можно раньше и проводить интенсивно.
Кроме обычных мероприятий по удалению яда в первые полчаса его можно нейтрализовать дачей глицерин-моноацетата — 100 мл на 500 мл воды (импортный препарат). Повторить дачу антидота можно через 0,5 часа. Судороги снимаются введением недолгодействующих барбитуратов (гексобарбитал, гексенал, оксибутират натрия), далее — кислород. При выделении из дыхательных путей обильной розовой пены и появлении клокочущего дыхания необходимо проводить комплексное лечение отека легких.
При угнетении центральной нервной системы внутривенно вводить 10% раствор кофеина по 2 мл 2 — 3 раза в день, 25% раствор кордиамина по 2 мл, фенамин в таблетках внутрь по 1 таблетке 2 — 3 раза в день.
При появлении гастроэнтерических симптомов давать внутрь настойку опия, белладонны — по 8 — 10 капель 3 раза в день; очистительные клизмы, внутривенно: гемодез, реополиглюкин — по 500 мл ежедневно. В случае появления болей в подреберье, пояснице (возможное поражение печени и почек), проводить лечение почечной и печеночной недостаточности.
Далее — симптоматическое лечение. Питание должно быть богатое витаминами, белками, жирами.
«Ароматические карбоновые кислоты- опасные, но верные друзья»
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Районная конференция-фестиваль творчества обучающихся
«Ароматические карбоновые кислоты-
опасные, но верные друзья »
Сведения об авторе:
Цивильская СОШ №2, 10 класс
Руководитель: Осипова Вероника Николаевна,
учитель химии, Цивильская СОШ №2
В последнее время мы чаще обращаем внимание на состав продуктов питания и косметических средств, и оказывается, что во многих продуктах используется консервант на основе бензойной кислоты.Антисептические, антибактериальные способности бензойной кислоты используют в фармакологической промышленности. На уроках органической химии мы изучили бензойную кислоту, но о ее производных, используемых в качестве лекарственных препаратов (салициловойи ацетилсалициловой кислотах) говорилось мало. Именно поэтому мы заинтересовались этими веществами и провели исследования. Результаты оформили в данной работе.
Целью нашей работы является изучение и исследование свойств бензойной кислоты и ее производных (на примере лекарственных препаратов)
Для достижения цели мы ставим следующие задачи:
1. Ознакомиться с литературой и изучить строение, свойства и применение бензойной, салициловой и ацетилсалициловой кислот;
2. Опытным путем сравнить свойства бензойной, салициловой и ацетилсалициловой кислот;
3. Научиться проводить качественные реакции салициловой кислоты для ее обнаружения в составе лекарств и косметических средств;
4. Опытно-экспериментальным путем проверить антисептические свойства кислот (подавление роста плесневых грибков на продуктах питания)
Объект исследования: Бензойная кислота, салициловая кислота и ацетилсалициловая кислота.
Предмет исследования:физико-химические свойства кислот.
Гипотеза исследования: бензойная кислота и ее производные обладают антисептическими свойствами.
Практическая значимость: Результаты исследования могут быть использованы на уроках химии, а также классных часах.
1.1Бензойная кислота. Строение, свойства и применение
Бензойная кислота относится к органическим кислотам.
Вещество отличается характерным запахом, хорошей растворимостью в жирах, этиловом спирте, эфире, крайне низкой растворимостью в воде. При нагревании порошок бензойной кислоты возгоняется.
Химические свойства соответствуют свойствам слабой органической кислоты.
Бензойная кислота — эффективное противогрибковое средство, убивает плесень, дрожжи, активна против многих видов бактерий и паразитов. Для человека не токсична, хотя при попадании в дыхательные пути в аэрозольной форме может вызвать сильный кашель и даже рвоту. Вызывает раздражение при попадании на кожу.
1.2Салициловая кислота. Строение, свойства и применение
Салициловая кислота (2-гидроксибензойная кислота): белые игольчатые кристаллы сладковато-кислого вкуса, без запаха, устойчивые на воздухе, но весьма хрупкие, ломаются при малейшем прикосновении; плохо растворима в холодной воде (1.8 г/л при 20 °C), но хорошо растворима в этаноле, диэтиловом эфире и других полярных органических растворителях; плотность 1,44г/мл, tпл=159°С.
Салициловая (старое название «спираевая») кислота отвечает формуле НОС6Н4СООН; в ее молекуле имеется бензольное кольцо с гидроксильной (-ОН) и карбоксильной (-СООН) группами, т.о. салициловая кислота является ароматической оксикислотой.
Салициловая кислота обладает слабыми антисептическими, раздражающими и кератолитическими (в больших концентрациях) свойствами и применяется в медицине наружно в мазях, пастах, присыпках и растворах при лечении кожных заболеваний.
1.3 Ацетилсалициловая кислота. Строение, свойства и применение
Ацетилсалициловая кислота представляет собой белые мелкие игольчатые кристаллы или лёгкий кристаллический порошок слабокислого вкуса.
Физико-химические свойства
Краткая химическая формула: C9H8O4
Константа диссоциации: pKa = 3.7
Ацетилсалициловая кислота производится путём нагревания салициловой кислоты с уксусным ангдридом:
Ацетилсалициловая кислота — лекарственное средство, оказывающее анальгезирующее (обезболивающее), жаропонижающее, противовоспалительное действие.
III . Практическая часть.
Для практической части исследовательской работы были взяты следующие вещества: кристаллическая бензойная кислота, салициловая кислота (2% спиртовой раствор), ацетилсалициловая кислота (таблетки аспирина).
С каждым из этих препаратов были проведены следующие опыты:
Опыт №1. Определение растворимости кислот в воде.
Обозначили пробирки под номерами (№ 1 –Бензойная кислота, №2 – растертая в ступке таблетки ацетилсалициловой кислоты (производство Россия)
Перенесли в пробирки по 0,1 г каждого вещества. Добавили в каждую пробирку 10 мл воды и отметили,что в пробирке №1 бензойная кислота в воде не растворяется и выпадает осадок белого цвета
В пробирке №2 ацетилсалициловая кислота в воде растворяется плохо, на стенках пробирки остаются белые хлопья (вспомогательные вещества).
Ацетилсалициловая кислота, согласно физическим свойствам малорастворимая в холодной воде. Аспирин практически не растворился в холодной воде и также плохо растворился и после нагревания. Внимательно изучив инструкцию по составу лекарств, пришли к выводу, что крахмал, который присутствует в качестве вспомогательного вещества в аспирине российского производства является малорастворимым веществом, что также сказалось на растворении аспирина.
После нагревания в пробирке с бензойной кислотой заметили, что на дне образовались белые «кристаллики льда». При значительном нагревании ацетилсалициловая кислота распадается на салициловую кислоту и уксусную кислоту (почувствовали появление запаха уксуса)
Опыт № 2. Определение рН растворов.
Методика исследования: рН исследуемых растворов в трех пробирках проверили с помощью универсальной индикаторной бумаги.
Наблюдаем красное окрашивание, следовательно, данные вещества проявляет кислотные свойства.
Опыт №3. Определение растворимости кислот в этаноле.
Внесли в пробирки по 0,1 г веществ и добавили 10 мл этанола. При этом наблюдали полное растворение бензойной кислоты и частичное растворение аспирина.
Результаты эксперимента показали, что ацетилсалициловая кислота лучше растворяется в этаноле, чем в воде, но образовался хорошо различимый белый осадок. В инструкции указывают, что недопустимо применение аспирина совместно с этанолом, это также доказало наше исследование, которое показало об изменении свойств лекарства. Следует сделать вывод о недопустимости применения алкогольсодержащих лекарств совместно с аспирином, а тем более с алкоголем.
Опыт №4. Определение фенолпроизводного в растворе.
Для качественного определения фенолпроизводного в растворе необходимо взять FeCl3. При его добавлении к раствору появляется фиолетовое окрашивание (справочник).
Взболтали по 0,1 г каждого препарата с 10 мл воды и добавили несколько капель хлорида железа ( III ).
При этом наблюдали, что раствор бензойной кислоты остался без изменений, в растворе салициловой кислоты появилось темно-фиолетовое окрашивание и выпал белый осадок, в случае с ацетилсалициловой кислотой появилось слабое фиолетовое окрашивание, обусловленное тем, что в аспирине содержатся примеси салициловой кислоты.
Затем мы выяснили, что фенолпроизводное, это очень опасное для здоровья человека вещество, и предположили, что возможно, фенольное соединение влияет на появление побочных эффектов на организм человека, при приеме ацетилсалициловой кислоты (данный факт упоминался еще в 19 веке).
Опыт №5. Салициловая кислота в косметике
В данном опыте мы проверим содержание салициловой кислоты в тонике. Нальем в чистые пробиркираствор салициловой кислоты и 2-3мл косметического средства. Прильем 2-3мл раствора CuSO4, затем данную смесь нагреем на пламени спиртовки, до появления изумрудно-зеленого окрашивания.
В пробирке с тоником мы наблюдаем окрашивание голубого раствора в изумрудно-зеленый. Следовательно, в данном косметическом средстве содержится салициловая кислота.
Опыт №6. Возгонка бензойной кислоты
На дно стеклянного стакана насыпали немного бензойной кислоты.
Опустили в стакан маленькую еловую веточку и накрыли чашечкой, наполненной холодной водой. Нагрели на пламени. По мере нагревания емкости, бензойная кислота начнет постепенно возгоняться и соприкасаясь с холодными стенками баночки и еловых веток, начнет оседать в виде маленьких игольчатых кристалликов, отдаленно напоминающих снег. Переход из твердого состояния в газообразное, минуя жидкое, называется возгонкой. Мы наблюдали возгонку бензойной кислоты.
Опыт №7. Антисептические свойства кислот.
Для доказательства антисептических свойств изучаемых кислот мы провели опыт с хлебом.
Поместили в четыре чашки Петри кусочки хлеба, обозначив каждую чашку номерами (№1, 2, 3, 4 соответственно), смочили кусочек хлеба в №4 водой (контрольный образец), в №1 бензойной кислотой, №2 салициловой кислотой, №4 – раствором ацетилсалициловой кислоты. Пробы выдержали в теплом месте при наличии влаги несколько дней.
В итоге, кусочек хлеба, смоченный водой, покрылся плесенью, а те, что были обработаны кислотойне заплесневели.
На основании проведенных экспериментов можно сделать следующие выводы:
При подготовке к исследованиям был выполнен обзор литературы, содержащей информацию о бензойной, салициловой и ацетилсалициловой кислотах, их свойствах и применении.
В ходе проведенных экспериментов были доказаны физические и химические свойства кислот, проведены качественные реакции.
Опытно-экспериментальным путем было доказано, что бензойная, салициловая и ацетилсалициловая кислоты подавляет рост плесневых грибков на продуктах питания.
Необходимо знать, что все лекарства действуют эффективно только в определенных условиях, которые всегда указаны в прилагаемой инструкции. Прежде чем пользоваться любым препаратом, надо внимательно ознакомиться с инструкцией, так как неумелое использование или хранение может представлять потенциальную опасность для здоровья. Лекарственные препараты также нужно применять по назначению.
V. Список литературы
Салициловая кислота / http://ru.wikipedia
Салициловая кислота / http://www.xumuk.ru
Анализ салициловой кислоты. Способы ее определения в фармпрепаратах / http://studyport.ru
Производные салициловой кислоты / http://www.kuban.su
Ароматические кислоты, гидроксикислоты и их производные / http://medicalarea.ru
1.1Бензойная кислота. Строение, свойства и применение
Бензойная кислота относится к органическим кислотам. Впервые была выделена еще в XVI веке из бензойной смолы — смолы стираксовых деревьев, растущих в Юго-Восточной Азии.
Бензойная кислота C6H5COOH в нормальных условиях представляет собой бесцветные игольчатые кристаллы, очень тонкие, блестящие. Вещество отличается характерным запахом, хорошей растворимостью в жирах, этиловом спирте, эфире, крайне низкой растворимостью в воде. При нагревании порошок бензойной кислоты возгоняется.
Химические свойства соответствуют свойствам слабой органической кислоты.
Бензойная кислота — эффективное противогрибковое средство, убивает плесень, дрожжи, активна против многих видов бактерий и паразитов. Для человека не токсична, хотя при попадании в дыхательные пути в аэрозольной форме может вызвать сильный кашель и даже рвоту. Вызывает раздражение при попадании на кожу.
Бензойная кислота токсична для семейства кошачьих даже в малых дозах.
Бензойная кислота и ее эфиры входят в состав природных веществ (эфирные масла гвоздики, туберозы, иланг-иланга; бензойная смола; ягоды брусники, клюквы; образуется в простокваше и йогурте), продуктов жизнедеятельности некоторых травоядных животных. Для нужд промышленности ее получают искусственным путем — синтезируют из других химических реактивов.
Применение бензойной кислоты
— В пищевой и косметической индустрии в качестве консерванта. Бензойная кислота и ее соли, бензоаты натрия, калия и кальция — это пищевые добавки Е210-Е213, обладающие выраженной противогрибковой активностью и антибактериальными свойствами. Используются при консервировании мясных, рыбных, фруктовых и ягодных продуктов, газированных, алкогольных и безалкогольных напитков, мармелада, майонеза, кетчупа, маргарина, мороженого, жевательной резинки. При производстве бальзамов, кремов, шампуней, губной помады.
— В фармакологии добавляется в средства против кашля, в дерматологические кожные мази против чесотки и грибковых заболеваний.
— В химической промышленности реактив используется как сырье для производства большого класса соединений — производных бензойной кислоты: эфиров, фенола, капролактама (сырья для искусственных тканей класса нейлона), пластификаторов, бензоилхлорида.
— Улучшает блеск алкидных лаков, их сцепление с поверхностью, прочность покрытия.
— Для калибровки калориметров.
Широко применяются также производные бензойной кислоты:
— Бензоат натрия хорошо растворяется в воде, поэтому он чаще всего используется в качестве пищевых добавок. Также это средство против коррозии; отхаркивающее средство; стабилизатор в процессах полимеризации.
— Бензоаты натрия, калия и кальция — пищевые добавки, консерванты, антисептики.
— Аммониевую соль добавляют как консервант в пищевые продукты; в средства против коррозии; как стабилизатор в клеи и латексы.
— Метиловый, этиловый, изоамиловый, бензиловый эфиры применяются при изготовлении парфюмерных композиций.
— Изоамиловый эфир входит в состав фруктовых эссенций.
— Метиловый эфир используется как растворитель эфиров целлюлозы.
— Бензиловый эфир применяется в бытовой химии в средствах от моли; в противовоспалительных препаратах; для фиксации запахов в парфюмерных отдушках; для растворения ароматических веществ.
— Хлорбензойная и нитробензойная кислоты используются в производстве красителей.
1.2Салициловая кислота. Строение, свойства и применение
Салициловая кислота (2-гидроксибензойная кислота): белые игольчатые кристаллы сладковато-кислого вкуса, без запаха, устойчивые на воздухе, но весьма хрупкие, ломаются при малейшем прикосновении; плохо растворима в холодной воде (1.8 г/л при 20 °C), но хорошо растворима в этаноле, диэтиловом эфире и других полярных органических растворителях; плотность 1,44г/мл, tпл=159°С.
Салициловая (старое название «спираевая») кислота отвечает формуле НОС6Н4СООН; в ее молекуле имеется бензольное кольцо с гидроксильной (-ОН) и карбоксильной (-СООН) группами, т.о. салициловая кислота является ароматической оксикислотой. Реакционная способность бензольного кольца салициловой кислоты определяется наличием двух заместителей с противоположными мезомерным и индуктивным эффектами: донорной гидроксильной функциональной группой и акцепторной карбоксильной, а также образованием внутримолекулярной водородной связи, которая позволяет стабилизировать карбоксилат-ион, что приводит к повышению ее кислотности.В результате, салициловая кислота значительно легче бензойной, но не так активно, как фенол, вступает в реакции электрофильного замещения.
1. При нагревании происходит декарбоксилирование с образованием фенола:
2. Салициловая кислота вступает в реакции нуклеофильного замещения по бензольному кольцу:
а) нитрование с образование 2,4,6-тринитрофенола:
б) бромирование с образованием 2,4,6- трибромфенола:
3. Как оксикислота, она вступает в реакции этерификации, образуя сложные эфиры:
4. Под действием гидроксида щелочного металла, салициловая кислота способна растворяться, при этом образуется фенолятосоль щелочного металла:
5. Под действием карбонатов щелочных металлов, салициловая кислота способна проявлять различные степени кислотности карбоксила и фенольного гидроксила. Реакция проходит с образованием солей. При этом карбоксильная группа салициловой кислоты разлагает карбонаты щелочных металлов, вытесняя слабую угольную кислоту. Фенольный гидроксил обладает более слабыми кислотными свойствами по сравнению с угольной кислотой и остается свободным, так как не способен разлагать эти соли:
6. Качественный метод обнаружения салициловой кислоты основан на образовании интенсивно окрашенных в сине-фиолетовый цвет комплексов с хлоридом железа (III). Это свойство проявляется не только в водном, но и в спиртовом растворе.
Салициловая кислота обладает слабыми антисептическими, раздражающими и кератолитическими (в больших концентрациях) свойствами и применяется в медицине наружно в мазях, пастах, присыпках и растворах при лечении кожных заболеваний. Благодаря антисептическому действию салициловую кислоту используют:
при консервировании пищевых продуктов;
в производстве азокрасителей, душистых веществ (сложных эфиров салициловой кислоты);
для колориметрических определениях Fe и Cu;
для отделения тория от других элементов.
Минимальные количества салициловой кислоты останавливают брожение виноградного сахара, парализуя деятельность дрожжевого грибка. Раствор 1:1000 задерживает развитие плесени; раствор 1:3000 задерживает рост сибиреязвенных палочек; 1 часть кислоты на 1500 воды вызывает полную остановку в развитии бацилл сибирской язвы. В 0,4 % растворе предотвращается гнилостное разложение мяса. Несмотря на столь значительные антисептические свойства, салициловая кислота как обеззараживающее вещество имеет в медицине сравнительно малое применение. Это связано с тем, что она трудно растворима и легко вступает в соединение с фосфорнокислыми и углекислыми солями, значительно теряя при этом свои дезинфицирующие свойства.
Салициловая кислота в косметике и медицине
Более широкое применение антисептических свойств салициловая кислота нашла в косметике. В уходе за проблемной кожей лица она просто незаменима. Салициловая кислота входит в группу аспирина, поэтому эффективно лечит воспаление и снимает покраснение, не вызывая при этом аллергии. Используя постоянно крем для лица с салициловой кислотой, можно не только избавиться от угревой сыпи, но и остановить процесс старения кожи.
Салициловая кислота широко применяется в дерматологии:
Совместно с борной кислотой входит в состав присыпок, применяемых при гипергидрозе (повышенном потоотделении) и экземе;
1-2% раствор салициловой кислоты применяется для обтирания кожи при себорее;
1% раствор салицилового спирта применяется для обмываний кожи при красных угрях;
5-10% салициловый спирт используется для обтирания кожи при отрубевидном лишае, эритразме, здоровых участков кожи вокруг очагов пиодермии и т. д;
2% салициловая мазь используется при лечении хронических дерматозов (псориаз и др.);
1% салициловый вазелин применяется совместно с ланолином как смягчающее средство при ихтиозе (втирается после горячих ванн);
Местное действие салициловой кислоты на кожу используется при лечении различных кожных болезней, в частности для борьбы с гиперкератозом (омозолелость) и повышенной потливостью.
Нежелательно использовать мази, содержащие салициловую кислоту в концентрации более 5% на больших площадях кожи (при распространённых дерматозах), так как кислота легко всасывается в кожу, что может вызвать отравление организма. При обработке салициловой кислотой в высоких концентрациях ороговевших участков кожи окружающее здоровую кожу нужно защищать от раздражения.
Производные салициловой кислоты
Не только салициловая кислота обладает антисептическими свойствами, но и ее производные. Препараты группы салициловой кислоты являются классическими противоревматическими средствами. Помимо противовоспалительного, они оказывают хорошо выраженное жаропонижающее и обезболивающее действие. Противовоспалительное действие салициловых препаратов не связано с антимикробным влиянием, а зависит от их способности стимулировать выделение адренокортикотропного гормона. Этот гормон в свою очередь усиливает отделение гормонов коры надпочечника, обладающих мощным противовоспалительным действием.
Препараты салициловой кислоты
Ацетилсалициловая кислота (аспирин С6Н4(ОСОСН3)СООН) используется в качестве жаропонижающего, обезболивающего средства, как противовоспалительный и противоревматический препарат.
Метилсалицилат применяется наружно в качестве противовоспалительного и обезболивающего средства в чистом виде, чаще в смесях с хлороформом, скипидаром и жирными маслами для растираний при невралгиях, ревматизме, миозитах и др.
Натрия салицилат применяется в качестве анальгезирующего, жаропонижающего, противовоспалительного, противоподагрического и противоревматического средства, особенно в лечении острого суставного ревматизма.
Салициламид применяется для лечения ревматизма, неревматических артритов и др. Салициламид менее токсичен чем другие салицилаты и лучше переносится пациентами (реже возникают побочные явления).
Салициловая мазь применяется как местное антисептическое и кератолитическое средство.
1.3 Ацетилсалициловая кислота. Строение, свойства и применение
Ацетилсалициловая кислота представляет собой белые мелкие игольчатые кристаллы или лёгкий кристаллический порошок слабокислого вкуса.
Краткая химическая формула: C9H8O4
Константа диссоциации: pKa = 3.7
Ацетилсалициловая кислота производится путём нагревания салициловой кислоты с уксусным ангдридом:
Ацетилсалициловая кислота при гидролизе распадается на салициловую и уксусную кислоты. Гидролиз проводят при кипячении раствора ацетилсалициловой кислоты в воде в течение 30 секунд. После охлаждения салициловая кислота, плохо растворимая в воде, выпадает в осадок в виде пушистых игольчатых кристаллов.
При нагревании с гидроксидом натрия в водном растворе ацетилсалициловая кислота гидролизуется до салицилата натрия и ацетата натрия.
Одна часть ацетилсалициловой кислоты растворяется в:
17 частях хлороформа
7 частях 96% этанола
Ацетилсалициловая кислота — лекарственное средство, оказывающее анальгезирующее (обезболивающее), жаропонижающее, противовоспалительное действие.
Механизм действия и профиль безопасности ацетилсалициловой кислоты хорошо изучены, её эффективность клинически апробирована, в связи с чем данный препарат входит в список важнейших лекарственных средств Всемирной организации здравоохранения, а также в перечень жизненно необходимых и важнейших лекарственных средств Российской Федерации.
Ацетилсалициловая кислота также широко известна под торговой маркой «Аспирин», запатентованной фирмой «Байер».
Аспирин используется для лечения ряда состояний, включая лихорадку, боль, ревматическую лихорадку и воспалительные заболевания, такие как ревматоидный артрит, перикардит и болезнь Кавасаки. Было показано, что более низкие дозы аспирина снижают риск смерти от сердечного приступа или риск развития инсульта в некоторых случаях. Есть некоторые доказательства того, что аспирин эффективен для профилактики колоректального рака, хотя механизмы этого эффекта неясны.