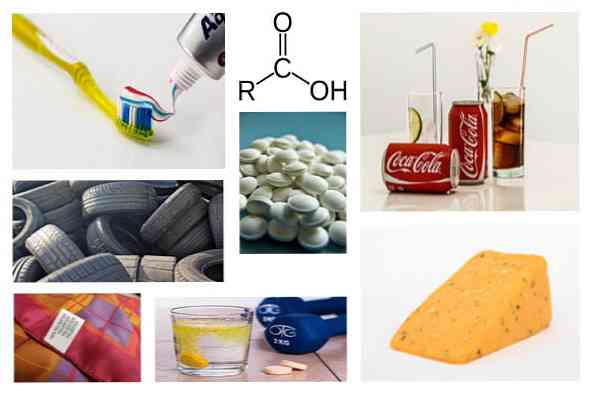
Карбоновая кислота для чего используется
Роль карбоновых кислот в жизни человека и их применение: описание
Содержание:
Карбоновые кислоты – органические соединения, которые содержат карбоксильную группу –СООН. Функциональная группа состоит из карбонильной =С=О и гидроксильной –ОН групп. Карбоновые кислоты в жизни человека играют важную роль.
Классификация карбоновых кислот
Также карбоновые кислоты можно разделить на несколько групп по строению углеводородного радикала на предельные, непредельные, ароматические и циклические.
Нахождение кислот в природе
Области применения карбоновых кислот
Предельные одноосновные кислоты
Уксусная кислота СН3СООН необходима для производства красителей. В составе продуктов она обозначается как Е260. Уксусную кислоту применяют при консервировании овощей, грибов и т. д.
Предельные двухосновные кислоты
Янтарная кислота НООС−СН₂−СН₂−СООН внутри организма участвует в метаболических процессах. С ее помощью осуществляется клеточное дыхание и синтез белков. Янтарная кислота выводит отравляющие вещества и уменьшает вредное действие алкоголя в организме.
Жирные ненасыщенные кислоты
Линолевая кислота С₁₇H₃₁COOH участвует в регуляции обмена белка и жиров, предотвращении накопления холестерина в организме. Она защищает клетки от преждевременного старения.
Применение карбоновых кислот в медицине
Масляная кислота СH₃(CH₂)₂СООН используется при лечении заболеваний ЖКТ. В кишечнике она образует кислую среду, в которой погибают патогенные микробы и развиваются полезные бактерии.
30 видов использования карбоновых кислот в повседневной жизни
использование карбоновых кислот они настолько обширны, что их можно разделить на несколько отраслей, таких как фармацевтическая (активная для производства лекарств на основе витамина С) или пищевая (производство безалкогольных напитков, приготовление добавок) и другие.
Карбоновые кислоты, по существу, представляют собой органические кислоты, имеющие карбоксильную группу среди своих компонентов, присоединенную к алкильной или арильной группе..
Они представлены в химической формуле следующим образом: COOH, и его название связано с конъюгацией или комбинацией карбонила (C = O) и гидроксила.
Если углеродная цепь имеет одну карбоксильную группу, кислоты называются монокарбоновыми кислотами или жирными кислотами, а если у вас две карбоксильные группы, кислоты называются дикарбоновыми кислотами..
Они также называются органическими кислотами и, как правило, являются «слабыми» кислотами, при этом только 1% молекул RCOOH диссоциирует на ионы (при обнаружении при комнатной температуре и в водном растворе)..
Они являются более слабыми кислотами, чем минеральные кислоты, такие как соляная кислота или серная кислота. Однако его кислотность выше, чем у спиртов.
Это полярные вещества, которые образуют водородные мостики между собой или с молекулами другого вещества.
Каковы основные области применения карбоновых кислот?
Карбоновые кислоты встречаются в природе в жирах, кисломолочных продуктах и цитрусовых, и среди их наиболее важных применений:
Пищевая промышленность
2- Консерванты (сорбиновая и бензойная кислоты).
3- Регулятор щелочности многих продуктов.
4- Производство безалкогольных напитков.
5- Антимикробные агенты против действия антиоксидантов. В этом случае наблюдается тенденция к жидким противомикробным препаратам, которые позволяют биодоступность.
6- Основной ингредиент общего уксуса (уксусная кислота).
7- Подкислитель в газированных напитках и продуктах питания (лимонная кислота и молочная кислота).
8- Помощник в созревании швейцарского сыра (пропионовая кислота).
9- Разработка сыра, квашеной капусты, квашеной капусты и безалкогольных напитков (молочная кислота).
Фармацевтическая промышленность
10- Жаропонижающее и обезболивающее (ацетилсалициловая кислота).
11- Активен в процессе синтеза ароматов, в некоторых препаратах (масляная или бутановая кислота).
12- Антимикотик (бензойная кислота в сочетании с салициловой кислотой).
13- Активен для изготовления лекарств на основе витамина С (аскорбиновой кислоты).
14- Фунгицид (каприловая кислота).
15- Производство некоторых слабительных (гидроксибутандиоевая кислота).
Другие отрасли
16- Производство пластмасс и смазочных материалов (сорбиновая кислота).
17- Производство лаков, эластичных смол и прозрачных клеев (акриловая кислота).
18- Производство красок и лаков (линолевая кислота).
19- Производство мыла, моющих средств, шампуней, косметики и средств для чистки металлов (олеиновая кислота).
20- Производство зубной пасты (салициловая кислота).
21- Производство вискозного ацетата, фотопленок и растворителей для красок (уксусная кислота).
22- Производство красителей и дубильных веществ (метановая кислота).
23- Производство смазочных масел, водостойких материалов и краски для сушки (пальмитиновая кислота).
24- Производство резины (уксусная кислота).
25- Обработка резины и гальваника.
27- Производство парфюмерии (бензойная кислота).
28- Производство пластификаторов и смол (фталевая кислота).
29- Разработка полиэфира (терефталевой кислоты).
30- Приготовление парафиновых свечей (стеариновая кислота).
В сельском хозяйстве они также склонны использовать его для улучшения качества посевов плодовых растений, увеличения количества и веса плодов на некоторых растениях, а также их внешнего вида и продолжительности после сбора урожая..
Карбоновые кислоты очень присутствуют в достижениях экспериментальной химии и биохимии, особенно в тех, которые связаны с ферментацией, необходимой для производства нескольких продуктов, представляющих коммерческий интерес (среди прочего, антибиотики, органические растворители и витамины).
Свойства карбоновых кислот
Некоторые свойства этих химических веществ:
растворимость
Первые четыре алифатических монокарбоновых кислоты являются жидкими и растворимыми в воде.
Это свойство уменьшается, если число атомов углерода увеличивается, поэтому начиная с додекановой кислоты они начинают растворяться в воде.
Точка кипения
Температура кипения этих веществ повышается благодаря наличию двойного водородного мостика между их компонентами..
Точка плавления
Это свойство меняется в зависимости от количества атомов углерода, так как они влияют на связь между молекулами..
Из 6 атомов углерода начинается нерегулярная высота в точке плавления.
Карбоновые кислоты. Свойства и применение карбоновых кислот
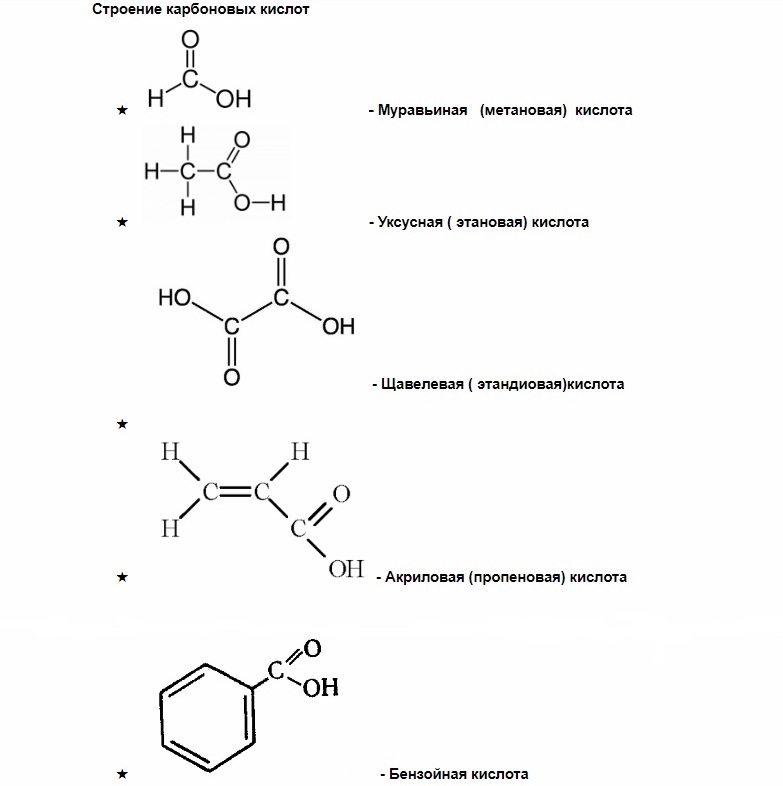
Все началось с уксуса, по крайней мере, открытие карбоновых кислот. Название объединяет органические соединения, содержащие карбоксильную группу COOH.
Важно расположение атомов именно в таком порядке, поскольку есть и другие кислородосодержащие соединения.
Уксусную кислоту из карбоновых открыли первой, но ее строение многие века оставалось тайной. Вещество знали, как продукт скисания вин.
Свойства карбоновых кислот
Отличаясь от другой органики наличием карбоксильных групп, карбоновые кислоты классифицируются по их числу.
Есть одно-, двух-, и многоосновные соединения. Одноосновные карбоновые кислоты выделяются связью между карбоксильной группой и углеводородным радикалом.
Соответственно, общая формула веществ группы: — CnH2n+1COOH. Уксусная кислота – одноосновная. Ее химическая запись: — CH3COOH. Еще проще строение муравьиного соединения: — COCOOH.
К простейшим отнесена и пропионовая кислота с формулой C2H5COOH. У остальных соединений одноосновного ряда есть изомеры, то есть, разные варианты строения.
У муравьиной же, уксусной и пропионовой кислот есть лишь один план строения.
Если у карбоновой кислоты формула с двумя карбоксильными группами, она может называться диосновной.
Общая запись веществ категории: — COOH-R-COOH. Как видно, карбоксильные группы располагаются по разные стороны линейной молекулы.
Подразделяют карбоновые соединения и по характеру углеводородного радикала. Химические связи между его атомами могут быть одинарными.
В этом случае перед нами предельные карбоновые кислоты. Наличие двойных связей указывает на непредельные вещества.
Формула непредельных карбоновых кислот может одновременно являться записью высших представителей класса.
Высшими называют соединения, в которых боле 6-ти атомов углерода. Соответственно, от 1-го до 5-ти атомов углерода – признак низших веществ.
Имея органическое происхождение, большинство карбоновых кислот пахнут, хотя бы слегка. Однако, есть группа особенно ароматных.
В их состав входит бензольное ядро. То есть, кислоты группы являются производными бензола. Его формула: — C6H6.
У вещества сладковатый запах. Поэтому, карбоновые кислоты с бензольным ядром именуют ароматическими. Причем, обязательна прямая связь ядра и карбоксильных групп.
По физическому состоянию карбоновые кислоты бывают, как жидкими, так кристаллическими. Имеется в виду агрегатность веществ при обычных условиях.
Часть соединений растворима в воде, другая часть смешивается лишь с органикой. Нюансы химического поведения зависят от количества в молекулах карбоксильных групп.
Так, типичная реакция карбоновых кислот одноосновной категории– окрашивание лакмусовой бумаги в красный цвет.
Классикой, так же, считается взаимодействие с галогенами, тогда как дикарбоновые соединения могут образовывать эфиры карбоновых кислот. Они «рождаются» во взаимодействии со спиртами.
Карбоновая кислота с двумя основаниями всегда содержит метиленовую группу, то есть, двухвалентную CH2.
Двухосновные соединения образуют, так же, соли карбоновых кислот. Они используются на производстве моющих средств, в частности, мыла.
Впрочем, о том, где пригождаются карбоновые кислоты и их соединения, поговорим отдельно.
Применение карбоновых кислот
В производстве мыла особенно важны стеариновая и пальмитиновая кислоты. То есть, используются высшие соединения.
Они делают мыльные брикеты твердыми и позволяют смешать фракции, расслаивающие без присутствия кислот.
Способность делать массы однородными пригождается и на производстве лекарств. Большинство связующих элементов в них – карбоновые кислоты.
Соответственно, применение реагентов внутрь, как и наружно, безопасно. Главное, знать предельную дозировку.
Превышение дозы, или концентрации кислот, ведет к разрушительным последствиям. Возможны химические ожоги, отравления.
Зато, едкость соединений наруку металлургам, мебельщикам, рестовраторам. Им карбоновые кислоты и смеси с ними помогают полировать и очищать неровные, заржавевшие поверхности.
Растворяя верхний слой металла, реагенты улучшают его внешний вид и эксплуатационные характеристики.
Химические карбоновые кислоты могут быть очищенными, или же, техническими. Для работы с металлами подойдут и последние.
Но, в качестве косметических и лекарственных средств применяют лишь высокоочищенные соединения. Такие нужны и в пищевой промышленности.
Около трети карбоновых кислот – официально зарегистрированные добавки, известные простым обывателям, как ешки.
На упаковках они отмечаются букврй Е и порядковым номером рядом с ней. Уксусная кислота, к примеру, пишется, как Е260.
Пищей карбоновые кислоты могут служить и для растений, входя в состав удобрений. Одновременно, можно создавать яды для вредоносных насекомых и сорняков.
Около трети карбоновых соединений используют в качестве протрав для тканей. Обработка необходима, чтобы материи равномерно окрашивались. С этой же целью реактивы применяют в кожевенной промышленности.
Добыча карбоновых кислот
Поскольку карбоновые кислоты биогенны, около 35% из них получают из природных продуктов. Но, химический синтез выгоднее.
Поэтому, при возможности переходят на него. Так, гиалуроновую кислоту, используемую для омоложения, долгое время добывали из пуповин младенцев и глаз крупного рогатого скота.
Теперь же, соединение получают биохимическим способом, выращивая на пшеничном субстрате бактерий, беспрерывно дающих кислоту.
Получение карбоновых кислот чисто химическим путем – это окисление спиртов и альдегидов.
Под последним понятием скрываются спирты, лишенные водорода. Реакция протекает так: — СН3 – СН2ОН → СН3 – СОН → СН3 – СООН.
От схемы производства, количества его ступеней, расходных материалов, во многом зависит стоимость конечных продуктов. Узнаем, каков ценник на карбоновые кислоты в их чистом виде.
Цена карбоновых кислот
Большинство карбоновых кислот продают большими объемами. Фасуют, обычно, по 25-35 килограммов. Жидкости разливают в канистры.
Так, 1000 граммов лимонной кислоты стоит в районе 80-ти рублей. Столько же берут за муравьиную и щавелевую.
Стоимость олеиновой – около 130-ти рублей за килограмм. Салициловая кислота оценивается уже в 300. Стеариновая кислота на 50-70 рублей дешевле.
Ряд карбоновых кислот оценивается в долларах, поскольку основные поставки ведутся из США и стран Евросоюза.
Оттуда поступает, к примеру, гиалуроновая кислота. За килограмм отдают уже не пару сотен рублей, а несколько сот баксов.
Отечественный продукт присутствует, но ему не доверяют, в первую очередь, клиенты салонов красоты.
Они знают, что омоложение с помощью гиалуроновой кислоты – придумка американцев, практикуемая ими полвека.
Соответственно, велика практика производства препарата, который должен быть качественным, ведь попадает в кожу и организм.
Применение карбоновых кислот
В первой статье рассказывалось о классификации, свойствах, группах карбоновых кислот. Сегодня речь пойдет о том, где, в основном, применяются карбоновые кислоты.
В магазине «ПраймКемикалсГрупп» можно купить многие карбоновые кислоты, и мы регулярно пополняем ими наш ассортимент. Расскажем подробнее о применении самых популярных, имеющихся у нас, карбоновых кислот.
Муравьиная кислота — одноосновная предельная карбоновая кислота, бесцветная жидкость с резким запахом. Применяется в медицине в качестве антисептика. Пищевая добавка E236, консервант при заготовке кормов в сельском хозяйстве. Используется в качестве растворителя, для уничтожения паразитов в пчеловодстве, реактив для протравы в текстильной индустрии.
 |  |  |
| Лимонная кислота | Стеариновая кислота | Бензойная кислота |
Лимонная кислота — многоосновная (трехосновная) карбоновая кислота. Твердое вещество с бесцветными кристаллами. Хорошо растворяется в воде. Считается слабой кислотой. Востребована в пищепроме как регулятор кислотности, вкусовая добавка, консервант (Е330). Используется в медицине, производстве косметических продуктов и препаратов бытовой химии; для травления печатных плат. В нефте- и газодобыче входит в состав буровых растворов; в строительстве ее добавляют в цементные и гипсовые смеси для замедления схватывания.
Стеариновая кислота — высшая одноосновная алифатическая кислота. Белые, нерастворимые в воде кристаллы. Широко используется для производства мыл, синтетических ПАВ, резины, густых смазок, клеящих паст; эфиров для пищепрома (стабилизаторы, антиоксиданты); входит в состав свечей, косметических продуктов. Применяется в текстильном и кожевенном производстве.
Бензойная кислота — одноосновная ароматическая кислота. Твердое кристаллическое вещество без цвета. Сильное антисептическое средство в пищепроме (добавка Е210) и медицине; сырье в органических синтезах для получения фенола, бензоилхлорида, пластификаторов (гликолей). Применяется в парфюмерии. В химпроме используется для изготовления красителей.
Салициловая кислота — двухосновная ароматическая кислота. Бесцветное твердое вещество, плохо растворяется в воде. Проявляет слабые кислотные свойства, а также свойства фенола. Используется в качестве антисептика в медицине, при производстве фармпрепаратов (наружных мазей и растворов, аспирина, противотуберкулезных средств и др.). Востребована в пищепроме как консервант. Применяется в орг. синтезе для изготовления красителей и ароматических веществ; реактив в колориметрии.
Щавелевая кислота — двухосновная предельная кислота. 
Карбоновые кислоты
Карбоксильная группа, в свою очередь, делится на карбонильную группу С=О и гидроксильную группу О-Н.
Карбоновые кислоты — группа органических веществ, в состав которых входят одна или несколько карбоксильных групп и углеводородный радикал (алкил).
Как вы можете заметить, у муравьиной кислоты одна группа СООН, у щавелевой две, а у лимонной – целых три.
По количеству карбоксильных групп карбоновые кислоты делятся на
В зависимости от структуры углеводородного радикала карбоновые кислоты делятся на
насыщенные — (муравьиная, щавелевая) — все связи углерода одинарные.
ненасыщенные (олеиновая, линолевая) — в составе радикала, между атомами углерода есть двойные связи.
ароматические (бензойная) — в составе радикала есть бензольное кольцо. Хотя имеют специфический запах все карбоновые кислоты, эта группа особенно ароматна.
Номенклатура карбоновых кислот.
Некоторые карбоновые кислоты имеют свои народные или тривиальные названия: муравьиная, уксусная, лимонная и т.д.
Также есть официальное название кислоты в зависимости от углеводородного радикала.
Для того, чтобы правильно назвать карбоновую кислоту, нужно:
1.Определить и пронумеровать самую длинную (главную) углеродную цепочку, считая от атома карбоксильной группы.
2. Назвать согласно номенклатуре углеводород (как это сделать, можно посмотреть в учебнике Химия.10 класс под редакцией Габриеляна на портале LECTA)
Получение карбоновых кислот
Первой открыли и начали использовать уксусную кислоту. Как и большинство открытий, произошло это случайно. Содержимое одной из винных бутылок, простояв дольше нужного времени, превратилось из вина в уксус.
На языке науки эта несложная реакция называется окислением спиртов.
Поскольку большинство из карбоновых кислот входят в состав природных продуктов, до сих пор около 30% получают из биологических объектов.
Однако карбоновые кислоты активно используются в фармацевтической, кожевенной, металлообрабатывающей промышленности и получать их химическим путем быстрее и дешевле. Одно дело год ждать превращения уксуса в вино, и совсем другое — окислить подходящий углеводород, добытый на месторождении полезных ископаемых.
Муравьиная кислота — в ряду карбоновых кислот эта самая скромная кислота с единственным атомом углерода в структуре обладает уникальными свойствами за счет одновременного присутствия в структуре карбонильной и карбоксильной групп.
При реакции муравьиной кислоты с аммиачным раствором оксида серебра образуется блестящий осадок — реакция серебряного зеркала.
HCOOH + Ag2O (аммиачный раствор) 
Больше интересных материалов:
Способы получения карбоновых кислот в химической промышленности
1. При помощи различных катализаторов (оксид серебра, перманганат калия) окислить подходящий альдегид
2 RCHO + O2 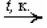
2. При помощи катализатора провести реакцию окисления спиртов
RCH2OH + O2 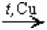
3. При помощи окисления различных углеводородов (алкинов, алкенов, алкилбензолов) можно получить соответствующие карбоновые кислоты.
2 C4H10 + 5O2 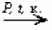
Физические свойства карбоновых кислот
Поскольку, карбоновые кислоты довольно разнородная группа веществ, говорить об общих физических свойствах, характерных для всех представителей группы неправомерно.
По количеству атомов углерода, входящих в состав вещества, карбоновые кислоты делятся на:
низшие — количество атомов от 1 до 3 — (муравьиная кислота) прозрачные жидкости с характерным запахом, отлично растворяются в воде
средние — количество атомов от 4 до 9 — ( валериановая кислота) жидкости с резким, неприятным запахом. маслянистые на ощупь.
высшие — количество атомов превышает 9 — (олеиновая кислота) — твердые вещества, нерастворяются в воде.
Молекулярная масса кислоты влияет на температуры плавления и кипения.
Плотность карбоновых кислот (за исключением муравьиной и уксусной кислот) меньше единицы.
Химические свойства карбоновых кислот.
1. Карбоновые кислоты обратимо диссоциируют. Проверить это можно с помощью лакмусовой бумажки. Она покраснеет, как в растворе любой кислоты.
Чем длиннее радикал, тем меньше степень диссоциации, и тем меньше проявляются кислотные свойства.
2. Карбоновые кислоты по своей природе являются слабыми кислотами, и участвуют во всех реакциях, характерных для неорганических кислот. Реагируют с солями, металлами, оксидами и гидроксидами металлов. В результате образуются соли карбоновых соединений и вода.