Кардиореанимация что это такое
Кардиореанимация что это такое
Проблема поражения легких при вирусной инфекции, вызванной COVID-19 является вызовом для всего медицинского сообщества, и особенно для врачей анестезиологов-реаниматологов. Связано это с тем, что больные, нуждающиеся в реанимационной помощи, по поводу развивающейся дыхательной недостаточности обладают целым рядом специфических особенностей. Больные, поступающие в ОРИТ с тяжелой дыхательной недостаточностью, как правило, старше 65 лет, страдают сопутствующей соматической патологией (диабет, ишемическая болезнь сердца, цереброваскулярная болезнь, неврологическая патология, гипертоническая болезнь, онкологические заболевания, гематологические заболевания, хронические вирусные заболевания, нарушения в системе свертывания крови). Все эти факторы говорят о том, что больные поступающие в отделение реанимации по показаниям относятся к категории тяжелых или крайне тяжелых пациентов. Фактически такие пациенты имеют ОРДС от легкой степени тяжести до тяжелой.
В терапии классического ОРДС принято использовать ступенчатый подход к выбору респираторной терапии. Простая схема выглядит следующим образом: низкопоточная кислородотерапия – высокопоточная кислородотерапия или НИМВЛ – инвазивная ИВЛ. Выбор того или иного метода респираторной терапии основан на степени тяжести ОРДС. Существует много утвержденных шкал для оценки тяжести ОРДС. На наш взгляд в клинической практике можно считать удобной и применимой «Берлинскую дефиницую ОРДС».
Общемировая практика свидетельствует о крайне большом проценте летальных исходов связанных с вирусной инфекцией вызванной COVID-19 при использовании инвазивной ИВЛ (до 85-90%). На наш взгляд данный факт связан не с самим методом искусственной вентиляции легких, а с крайне тяжелым состоянием пациентов и особенностями течения заболевания COVID-19.
Тяжесть пациентов, которым проводится инвазивная ИВЛ обусловлена большим объемом поражения легочной ткани (как правило более 75%), а также возникающей суперинфекцией при проведении длительной искусственной вентиляции.
Собственный опыт показывает, что процесс репарации легочной ткани при COVID происходит к 10-14 дню заболевания. С этим связана необходимость длительной искусственной вентиляции легких. В анестезиологии-реаниматологии одним из критериев перевода на спонтанное дыхание и экстубации служит стойкое сохранение индекса оксигенации более 200 мм рт. ст. при условии, что используются невысокие значения ПДКВ (не более 5-6 см. вод. ст.), низкие значения поддерживающего инспираторного давления (не более 15 см. вод. ст.), сохраняются стабильные показатели податливости легочной ткани (статический комплайнс более 50 мл/мбар), имеется достаточное инспираторное усилие пациента ( p 0.1 более 2.)
Достижение адекватных параметров газообмена, легочной механики и адекватного спонтанного дыхания является сложной задачей, при условии ограниченной дыхательной поверхности легких.
При этом задача поддержания адекватных параметров вентиляции усугубляется присоединением вторичной бактериальной инфекции легких, что увеличивает объем поражения легочной ткани. Известно, что при проведении инвазинвой ИВЛ более 2 суток возникает крайне высокий риск возникновения нозокомиальной пневмонии. Кроме того, у больных с COVID и «цитокиновым штормом» применяются ингибиторы интерлейкина, которые являются выраженными иммунодепрессантами, что в несколько раз увеличивает риск возникновения вторичной бактериальной пневмонии.
В условиях субтотального или тотального поражения дыхательной поверхности легких процент успеха терапии дыхательной недостаточности является крайне низким.
Собственный опыт показывает, что выживаемость пациентов на инвазивной ИВЛ составляет 15.3 % на текущий момент времени.
Алгоритм безопасности и успешности ИВЛ включает:
В связи с тем, что процент выживаемости пациентов при использовании инвазивной ИВЛ остается крайне низким возрастает интерес к использованию неинвазивной искусственной вентиляции легких. Неинвазивную ИВЛ по современным представлениям целесообразно использовать при ОРДС легкой степени тяжести. В условиях пандемии и дефицита реанимационных коек процент пациентов с тяжелой формой ОРДС преобладает над легкой формой.
Тем не менее, в нашей клинической практике у 23% пациентов ОРИТ в качестве стартовой терапии ДН и ОРДС применялась неинвазивная масочная вентиляция (НИМВЛ). К применению НИМВЛ есть ряд ограничений: больной должен быть в ясном сознании, должен сотрудничать с персоналом. Допустимо использовать легкую седацию с целью обеспечения максимального комфорта пациента.
Критериями неэффективности НИМВЛ являются сохранение индекса оксигенации ниже 100 мм рт.ст., отсутствие герметичности дыхательного контура, возбуждение и дезориентация пациента, невозможность синхронизации пациента с респиратором, травмы головы и шеи, отсутствие сознания, отсутствие собственного дыхания. ЧДД более 35/мин.
В нашей практике успешность НИМВЛ составила 11.1 %. Зав. ОАИР: к.м.н. Груздев К.А.
Помощь пациентам с подозрением на инфаркт миокарда: от приезда «скорой» до спасения жизни
Региональный сосудистый центр был создан в основном для того, чтобы оказывать специализированную высокотехнологичную помощь экстренным больным, чаще всего – тем, кто поступает в больницу с подозрением на острый инфаркт или острый инсульт. Эти заболевания, как правило, вызваны тромбозом крупной артерии, снабжающей кровью участок сердечной мышцы или мозга, соответственно. Эти состояния – самые частые из неотложных в нашей сфере. Другие заболевания сосудов – например, сужения почечных артерий, сосудов рук/ног или органов брюшной полости – гораздо реже угрожают жизни пациента, хотя и в этих сосудистых бассейнах случаются настоящие катастрофы.
Наш опыт показывает, что ведение срочных больных неизбежно пересекается с параллельной плановой работой. Это не только так называемая первичная и вторичная лекарственная профилактика. Плановые инвазивные вмешательства, например стентирование коронарных или сонных артерий, призванные предотвратить катастрофы в сердце или мозге, выполняются врачами, участвующими в лечении острых пациентов. Нередки случаи, когда пациент, пришедший на плановую консультацию в консультативно-диагностический центр больницы, немедленно попадает к нам в стационар – если врач, ведущий прием, подозревает инсульт или инфаркт миокарда.
Первостепенная задача – быстрая и точная постановка диагноза
Для тех, у кого диагноз подтвердился, с первых минут пребывания в больнице начинается борьба за их жизнь и за их полноценный функциональный статус после выписки. И здесь основу лечения составляют экстренные внутрисосудистые вмешательства, эффективность которых тем выше, чем раньше они начаты.
Рассмотрим ситуацию, когда в наш центр поступает больной с подозрением на инфаркт миокарда.
Подозрение на инфаркт – это всего лишь предварительный диагноз. К счастью, диагноз подтверждается далеко не у всех больных, которые приезжают к нам на «скорой помощи» или самостоятельно. Первостепенная задача наших специалистов, как сказано выше, подтвердить или опровергнуть диагноз, оценить состояние пациента и наметить дальнейший план действий.
Когда диагноз очевиден. Наиболее ясна ситуация, когда пациент обнаружил у себя симптомы начинающегося инфаркта и вызвал скорую помощь. Врачи скорой помощи сделали пациенту электрокардиографию и установили, что у него инфаркт миокарда с подъемом сегмента ST. Для бригады скорой помощи включается «счетчик»: они должны в течение 10 минут с момента регистрации ЭКГ поставить диагноз и в течение 20 минут после постановки диагноза доставить пациента в стационар для получения специализированной высокотехнологичной помощи.
Благодаря современным средствам связи нас фактически немедленно ставят в известность о том, что к нам везут «острого» пациента, мы начинаем готовить операционную. По стандарту, нам дается 1 час с момента поступления больного и до начала чрезкожного коронарного вмешательства. Раньше стандарт определялся формулой «от двери до баллона», раздутого в просвете артерии. Сейчас, как таковой баллон используют не всегда, а устранение окклюзии сосуда у всех больных начинается с введения проводника в просвет пораженной тромбозом артерии. Поэтому сейчас мы говорим – время «от двери до проводника». Но суть вмешательства остается той же: с момента приезда пациента с инфарктом миокарда с подъемом сегмента ST и до начала операции должно пройти не более 60 минут. В нашем центре мы обычно справляемся за 30-35 минут.
Можно ли еще сократить время подготовки пациента к операции? В свое время во всем мире, в том числе и в России, предпринимались попытки сократить этот временной интервал подготовки к операции, однако опыт показал, что из-за спешки снижается качество подготовки, растет число врачебных ошибок, особенно с дозированием лекарств. Это своего рода предел для человека, которому необходимо принимать ответственные решения и спасать жизнь пациенту. Считаю, что вместо того, чтобы пытаться свести время оказания помощи к нулю, лучше добиваться того, чтобы в каждом случае все нуждающиеся могли получить эту помощь в течение требуемых 60 минут.
Когда диагноз неясен: при сходных с инфарктом миокарда симптомах плохое самочувствие больного может быть связано не с сердцем и его сосудами, а, например, с заболеваниями пищевода или легких, с травмой грудной клетки. Возможно, за жалобами больного и изменениями на ЭКГ, стоит даже более острая и более серьезная, чем инфаркт миокарда, проблема, например – расслаивающая аневризма аорты. Она требует совершенно другого лечения.
Как диагностируется инфаркт миокарда?
Основу современной диагностики составляет информация из лаборатории: у больного берут на анализ кровь для определения содержания в крови маркеров повреждения сердечной мышцы – тропонинов (Тn T и Tn I). Анализ берется повторно с интервалом в 1-3 часа. Оценка изменений уровня этих показателей во времени позволяет подтвердить или исключить диагноз у большинства больных.
Однако лабораторная диагностика не идеальна. Иногда мы имеем ложноположительный результат, редко – ложнноотрицательный. Часть больных, прежде всего, больных с явным инфарктом миокарда с подъемом сегмента ST на ЭКГ, мы подаем в рентгеноперационную, не дожидаясь результатов определения уровня тропонинов, тем более – повторного.
Сомнительные случаи разрешаются с помощью других методов инструментальной диагностики.
Такая простая и привычная процедура, как рентгенография грудной клетки, позволяет исключить целый ряд возможных причин возникших симптомов.
Мультиспиральная компьютерная томография с применением контраста – в удачном исполнении позволяет нам одновременно видеть состояние коронарных артерий, аорты и сосудов легких. Результат позволяет выявить эмболию ветвей легочной артерии и разрыв/аневризму аорты – состояния в чем-то гораздо более опасные, чем инфаркт миокарда.
Если обследования подтверждают диагноз или выявляют альтернативное опасное для жизни состояние, пациент госпитализируется в так называемое отделение реанимации и интенсивной терапии.
В нашем центре редко звучат слова «Пациент в реанимации»
Во-первых, это просто по смыслу неверно. Реанимация – это достаточно короткий процесс экстренного возвращения почти умершего пациента к жизни. Если больной относительно спокойно получает наблюдение и лечение в течение одного-двух дней, находясь под нашим пристальным вниманием – это уже не «реанимация».
Во-вторых, сама фраза «больной в реанимации» сопряжена с серьезной психологической травмой как для самого пациента, так и для его родственников. Нам регулярно приходится сообщать близким больного о его состоянии – и слово «реанимация» здесь должно звучать как можно реже.
Мы говорим – пациент в палате интенсивной терапии или интенсивного наблюдения. Это значит, что его состояние под нашим контролем, мы настороже и, разумеется, готовы в случае чего провести все необходимые мероприятия, включая реанимацию.
В центре оборудованы 4 современных рентгеноперационных. Две из них – для «острых» больных. Одна предназначена для эндоваскулярного лечения нарушений ритма и проводимости сердца. Четвертая – гибридная операционная, в ней проводятся комбинированные операции, в которых могут быть задействованы и кардиохирурги, и сосудистые хирурги. Чаще всего это операции на аорте или малоинвазивные операции по замене аортального клапана сердца.
Больного с острым инфарктом миокарда, при отсутствии противопоказаний, скорее всего прооперируют малотравматичным эндоваскулярным методом, используя для доступа к сосудам сердца одну из артерий руки. После таких операций пациент не ограничен в активности, пребывает в стационаре от 3 до 6 суток, после чего его выписывают домой. До выписки больному подберут лекарства, призванные предотвратить повторный инфаркт миокарда и отсроченные осложнения уже случившегося. Больной будет детально проинформирован о необходимых изменениях в его образе жизни (питании, физической активности, отказе от вредных привычек), необходимых для профилактики повторных сосудистых катастроф.
Сердечно-легочная реанимация у взрослых
В основе мероприятий, проводимых у пациентов с остановкой кровообращения и дыхания, лежит концепция «цепочки выживания». Она состоит из действий, выполняемых на месте происшествия, при транспортировке, в операционной и отделении реанимации, а также при п
В основе мероприятий, проводимых у пациентов с остановкой кровообращения и дыхания, лежит концепция «цепочки выживания». Она состоит из действий, выполняемых на месте происшествия, при транспортировке, в операционной и отделении реанимации, а также при последующей реабилитации. Самым уязвимым и при этом очень важным звеном является первичный реанимационный комплекс, проводимый на месте происшествия, поскольку через 3–5 мин после остановки кровообращения и дыхания при обычной температуре тела развиваются необратимые изменения головного мозга пострадавшего.
Возможны как первичная остановка дыхания, так и первичная остановка кровообращения. Выявление первичной остановки дыхания (инородные тела дыхательных путей, электротравма, утопление, поражение центральной нервной системы (ЦНС) и др.) маловероятно на догоспитальном этапе, так как к моменту прибытия бригады скорой помощи успевает развиться фибрилляция желудочков или асистолия.
Причиной первичной остановки кровообращения могут быть острый инфаркт миокарда, аритмия различного характера, электролитный дисбаланс, тромбоэмболия легочной артерии, разрыв и расслоение аневризмы аорты и т. д.
Различают три варианта прекращения сердечной деятельности: асистолия, фибрилляция и электромеханическая диссоциация. Асистолия может быть первичной или вторично развиться после фибрилляции желудочков. В первом случае шансов на успех реанимации больше, во втором, при истощении резервов миокарда, — меньше. Иногда изолинию на электрокардиограмме (ЭКГ) воспринимают как асистолию, но она может наблюдаться и при неисправности электрокардиографа, случайном отсоединении электродов, низкоамплитудной ЭКГ и т. п. Электромеханическая диссоциация характеризуется наличием электропродукции сердца, но отсутствием сокращения миокарда.
При фибрилляции возникают разрозненные, беспорядочные, неэффективные сокращения миокарда. И здесь имеют значение применение прекордиального удара и рано выполненная дефибрилляция.
Признаками остановки кровообращения являются: потеря сознания; отсутствие пульса на сонных артериях; остановка дыхания; судороги; расширение зрачков и отсутствие их реакции на свет; изменение цвета кожных покровов.
Для подтверждения остановки сердца достаточно наличие первых трех признаков.
Сердечно-легочная реанимация (СЛР) не показана, и ее можно не начинать в случаях: если установлено, что с момента остановки сердца (при нормальной температуре окружающей среды) прошло свыше 25 мин; больные заранее зафиксировали свой отказ от СЛР.
В иных случаях при оказании помощи на догоспитальном этапе СЛР начинается немедленно.
Поводом для прекращения СЛР является отсутствие признаков восстановления кровообращения и дыхания при использовании всех доступных методов СЛР в течение 30 мин.
СЛР на догоспитальном этапе
Она включает в себя элементарное поддержание жизни (по П. Сафару) или первичный реанимационный комплекс (по А. Зильберу):
Кроме того, производятся мероприятия (рис. 1) специализированного реанимационного комплекса (по А. Зильберу), включающего:
Восстановление проходимости дыхательных путей. При возникновении неотложных состояний проходимость дыхательных путей часто нарушается в результате западения языка, аспирации рвотными массами, кровью. Необходимо очистить ротоглотку и выполнить «тройной прием Сафара» — разогнуть голову в шейном отделе позвоночника; выдвинуть нижнюю челюсть вперед и вверх; открыть рот. Если невозможно исключить перелом шейного отдела позвоночника и разгибать голову нельзя, ограничиваются выдвижением челюсти и открытием рта.
Если зубной протез цел, его оставляют в полости рта, так как это сохраняет контур рта и облегчает проведение ИВЛ.
При обструкции дыхательных путей инородным телом пострадавшего укладывают на бок и производят 3–5 резких ударов нижней частью ладони в межлопаточной области, затем пальцем пытаются удалить инородное тело из ротоглотки. Если этот метод неэффективен, то выполняют прием Геймлиха: ладонь реаниматолога укладывается на живот между пупком и мечевидным отростком, вторую руку укладывают на первую и производят толчок снизу вверх по средней линии. После чего также пальцем пытаются удалить инородное тело из ротоглотки.
В связи с опасностью инфицирования реаниматолога при контакте со слизистой рта и носа, а также для повышения эффективности ИВЛ используется ряд приспособлений: устройство «ключ жизни»; пероральный воздуховод; трансназальный воздуховод; фаринго-трахеальный воздуховод; двухпросветный пищеводно-трахеальный воздуховод (комбитьюб); ларингеальная маска.
Большим шагом вперед явилось создание ларингеальной маски. Ларингеальный масочный воздуховод представляет собой интубационную трубку, которая не проходит через голосовую щель в трахею, а имеет на дистальном конце миниатюрную маску, которая надевается на гортань. Манжета, прилегающая к краю маски, раздувается вокруг гортани, обеспечивая герметичность по ларингеальному периметру. Ларенгеальная маска обладает множеством преимуществ, в том числе позволяет обойтись без разгибания головы в шейном отделе, если к этому имеются противопоказания.
Каждый врач скорой помощи должен уметь выполнять интубацию трахеи. Этот метод позволяет обеспечить оптимальную проходимость дыхательных путей, снизить вероятность регургитации при проведении комплекса реанимационных мероприятий, обеспечить более высокое внутрилегочное давление. Кроме того, через интубационную трубку можно вводить некоторые медикаменты.
ИВЛ. Искусственное дыхание — это вдувание воздуха или обогащенной кислородом смеси в легкие пациента без или с применением специальных устройств. Выдыхаемый человеком воздух содержит от 16 до 18% кислорода, поэтому эффективнее ИВЛ атмосферным воздухом, либо кислородо-воздушной смесью. Каждое вдувание должно занимать 1–2 с, а частота дыхательных движений составлять 12–16 в минуту. Адекватность ИВЛ оценивается по периодическому расширению грудной клетки и пассивному выдыханию воздуха.
Бригадой скорой помощи обычно используются либо воздуховод, либо лицевая маска и мешок Амбу, либо интубация трахеи и мешок Амбу.
Непрямой массаж сердца. После остановки кровообращения в течение 20–30 мин в сердце сохраняются функции автоматизма и проводимости, что позволяет его «запустить». Основной целью массажа сердца является создание искусственного кровотока. За время проведения непрямого массажа сердца происходит сжатие не только сердца, но и легких, которые содержат большое количество крови. Этот механизм принято называть грудным насосом.
При проведении непрямого массажа сердца пациент должен находиться на твердой поверхности. Одна ладонь реаниматолога располагается на нижней трети грудины по средней линии, вторая упирается в тыльную поверхность первой. Время надавливания и отпускания — 1 с, интервал между компрессиями — 0,5–1 с. Грудина у взрослого должна «продавливаться» на 5–6 см. При выполнении каких-либо лечебных мероприятий перерыв в тракциях не должен превышать 5–10 сек. Критериями эффективности непрямого массажа сердца являются появление пульсовых толчков на сонных артериях, артериальное давление на уровне 60–70 мм рт. ст., изменение цвета кожных покровов.
Если помощь оказывает один реаниматолог, то на два вдувания воздуха выполняются 15 тракций, если работают два реаниматолога, то на одно вдувание воздуха осуществляется 5 тракций.
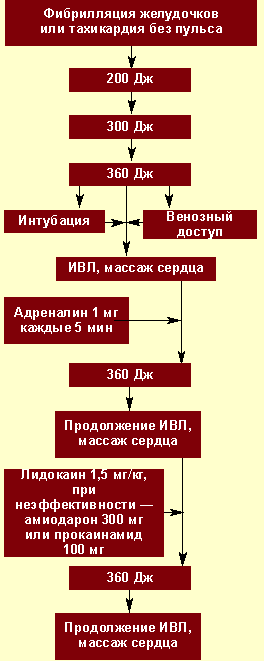 |
| Рисунок 2. Алгоритм неотложной помощи при фибрилляции желудочков |
Электрическая дефибрилляция сердца (ЭДС). Это важнейший компонент СРЛ. ЭДС эффективна только при сохранности энергетического ресурса миокарда, т. е. при регистрации на ЭКГ крупноволновых осцилляций от 0,5 до 1 мВ и более (рис. 2). Если же отмечаются низкие, аритмичные, полиморфные осцилляции, а также асистолия, то начинают с ИВЛ, непрямого массажа и медикаментозной терапии (рис. 3), добиваются перехода асистолии или мелковолновой фибрилляции желудочков в крупноволновую фибрилляцию и применяют ЭДС.
Первый разряд для ЭДС — 200 Дж, при неэффективности второй — 300 Дж, при неэффективности третий — 360 Дж. Перерыв между разрядами минимальный — для контроля ритма. Непрямой массаж сердца и ИВЛ прерываются только на момент разряда. Если первая серия из трех разрядов оказывается неэффективной, то на фоне продолжающейся ИВЛ, непрямого массажа сердца, медикаментозной терапии проводится вторая серия разрядов в той же последовательности.
В настоящее время на догоспитальном этапе применяются автоматические наружные дефибрилляторы, в этом случае ЭКГ регистрируется с электродов дефибриллятора, приложенных к грудной клетке. Дефибриллятор регистрирует ритм сердца и производит его автоматический анализ; при выявлении желудочковой тахикардии или фибрилляции желудочков конденсаторы автоматически заряжаются, и прибор дает разряд. Эффективность автоматических дефибрилляторов очень высока. Кроме автоматических, используются полуавтоматические наружные дефибрилляторы.
Медикаментозная терапия при сердечно-легочной реанимации. Медикаменты при СЛР могут вводиться: в периферическую вену; в центральную вену; в трахею.
По понятным причинам внутримышечный путь введения не показан. При наличии возможности катетеризируется периферическая вена. Если реаниматолог опытный и хорошо владеет методикой пункции центральной вены, можно использовать этот способ. Проблема в том, что в этом случае приходится прерывать реанимационные мероприятия, а перерыв больше, чем на 5–10 с нежелателен. Внутритрахеальный путь удобен, если выполнена интубация трахеи, в крайнем случае можно ввести препараты в трахею через перстнещитовидную мембрану. Эндотрахеально допустимо вводить адреналин, атропин, лидокаин. Препараты лучше развести в 10–20 мл 0,9% раствора натрия хлорида.
Адреналин остается средством выбора при остановке кровообращения. При асистолии и электромеханической диссоциации он «тонизирует» миокард и помогает «запустить» сердце, мелковолновую фибрилляцию переводит в крупноволновую, что облегчает ЭДС. Дозы: по 1–2 мг внутривенно струйно с интервалом 5 мин, суммарно обычно — до 10-15 мг.
М-холинолитик атропин снижает тормозящее влияние ацетилхолина на синусовый узел и атриовентрикулярную проводимость и, возможно, способствует высвобождению катехоламинов из мозгового слоя надпочечников. Он показан при брадисистолии и асистолии. Дозы — 1 мг, можно повторить через 5 мин, но не более 3 мг за время реанимации.
Все антиаритмические препараты оказывают депрессивное действие на миокард и небезвредны для организма пациента. При развившейся фибрилляции желудочков их следует вводить лишь в случае нескольких неудачных попыток ЭДС, поскольку они, подавляя желудочковую эктопию затрудняют восстановление самостоятельного ритма. Лидокаин считается одним из наиболее эффективных средств при рефрактерной фибрилляции желудочков, устойчивой желудочковой тахикардии и тахикардиях неясной этиологии с широким комплексом QRS. Доза для насыщающего внутривенного введения — 1,5 мг/кг струйно (обычно — 75–100 мг). Одновременно начинается введение поддерживающей дозы 2–4 мг в мин. Для этого 1 г лидокаина разводится в 250 мл 5% раствора глюкозы.
Показанием к введению гидрокарбоната натрия можно считать затянувшуюся более чем на 15 мин реанимацию, если остановке сердца предшествовали выраженный метаболический ацидоз или гиперкалиемия. Доза — 1 ммоль/кг, внутривенно однократно, при повторном введении она уменьшается вдвое. Некоторые авторы считают, что при адекватных реанимационных мероприятиях гидрокарбонат натрия следует вводить только под контролем кислотно-основного состояния, поскольку организм значительно хуже адаптируется к алкалозу, чем к ацидозу.
В качестве инфузионных растворов целесообразно использовать 0, 9% раствор хлорида натрия, но наиболее эффективен раствор лактата Рингера по Хартману, а из коллоидов — растворы со средней молекулярной массой, содержащие гидроксиэтилкрахмал — волювен или венофундин.
Во всех случаях показана экстренная госпитализация по витальным показаниям в отделение реанимации и интенсивной терапии.
И. Г. Труханова, доктор медицинских наук, доцент
Е. В. Двойникова, кандидат медицинских наук, доцент
Самарский государственный медицинский университет, Самара